| 再生讲堂 | ►新增栏目:《空间生物试验专题》 |
2009年2月2日,广西仡佬族青年郭光明突遇车祸,生命垂危。在生死的最后时刻,他的兄弟郭小奎与家人商议后代替一直昏迷的弟弟做出了无偿捐献所有能用的器官的决定,面对传统伦理压力他们这个普通的农民家庭选择了面对和背负。在深圳红十字会的。。。
|
人类关于再生的最早想法,应该是来源于”圣经”和”古希腊神话”两个故事。 (一)圣经-上帝用亚当的一根肋骨创造了一个女人 上帝在创造了天和地,光和空气,山和海,花草和树木,太阳、月亮和星星,鸟和鱼,最后,又造了各类的动物之后的第六天上帝创造了人。 。。。 【更多网络话题】 |
|
 |
|
- 再生,是人类“永恒”的话题
- 人类关于再生的话题层出不穷,既有盼望“长生不老”的神话实现,也有期待“器官再生”的医学奇迹出现,以救治那些因器官衰竭或肢体缺失而需要移植的患者?再生,是人类自古以来的“永恒”的话题。
小说“癌人”来自王晋康科幻精品集,其故事梗概是:
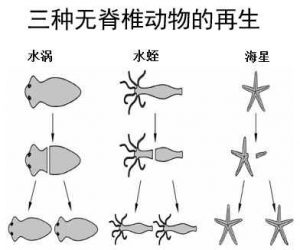
• 自然界中,诸多低等级动物仍然具有很强的肢体再生能力,例如:
-斑马鱼能再生出它的鳍、鳞、脊髓和部分心脏;
-蝌蚪:可以在几小时内再生出新的尾巴而不留下任何伤疤,不过,当蝌蚪长成青蛙时,这种功能就莫名其妙地消失了。
-切下海参的一点点肉就能长出一整个新海参;
-海星:能长胳膊和大部分身体;
-蜘蛛能长出断了的腿;
-多肠目动物蛆:被分割成许多部分后,每一部分都可以再生成为一个新的机体,而且一次可以再生出300个新的机体;
-真涡虫:是一种扁形虫,被切成1/279后仍能让每一个切片再生,成为完整的新真涡虫。
- 然而,对于人类等高级动物,断肢再生实际难度非常高。
-肢体在组织学、解剖学上看是非常复杂的玩意,骨骼、关节、韧带、肌肉、筋膜、神经血管淋巴管等等乱七八糟的玩意一大堆,想要体外再生难于登天。
-脊椎动物自发进行断肢再生的技能点在两栖类之后就被ban掉了。
-前一段时间的指尖再生倒是有点意思,但指尖的结构远比肢体大部分结构简单,主要就是骨骼和皮肤以及结缔组织,这个技术显然不可能对关节这种在解剖结构和组织细胞层面都很复杂的结构进行再生,我甚至很怀疑再生的指尖在触觉等神经功能上能恢复多少,弄不好就是个样子货。
-目前对肢体伤残最靠谱的应对发展是基于脑机接口(BCI or BMI)的神经假体/义体,而且相对来说比较成熟了,前一阵子刚有一款智能假肢被FDA批准上市了。

该智能义肢叫“卢克手臂(Luke arm)”,取名于《星球大战·帝国反击战》中的主人公卢克·天行者(Luke Skywalker)。他在与父亲达斯维达交战中不幸失去右手,幸好在科幻电影世界的高科技帮助下,及时接上高仿真度的 1:1 义肢。
这一科幻故事,在若干年后的今天变成了现实,Segway 发明者狄恩·卡门,曾在两年前的 TED 大会上公布了旗下科研公司 DEKA 的智能义肢 DEKA Arm System,这种义肢的革命之处在于能够让佩戴者使用意念控制,让残障人士也能轻松做出翻书、喝水等各种日常生活中动作。并已经取得美国食品药品监督管理局(FDA)认证,换言之离正式投入商业使用已不远。
Luke Arm的工作原理:这款智能义肢与一条人类手臂的重量类似,但却由复杂的感应器和马达组所驱动;通过采集肌肉上的肌电信号,然后通过内置的微型电脑分析解读动作信息,随后再转化为行动,以完成肢体的各种动作。
-由干细胞培育而来 首先的前提,是干细胞重生的机制能够被解锁。其风险是患肿瘤的几率会大大提高。有网友打趣,这一技术一旦实现,打算卖肾买水果机的会流下了屈辱的泪水?
-从动物身上“收割”人体器官--也就是未来人类的“狼心狗肺”。当然,需要克服免疫排斥等问题。

- 器官再生–这样的话题还会继续…
- 全套人造器官+200岁高龄的大脑>>>是生命奇迹?

-美国科学家研究认为人类大脑至少可以存活200年。
-然而光有大脑这个耐用的“控制器”是远远不够的,身体内部零件的必然老化甚至衰亡,让大脑即便长命200岁,也难施才干,人类依然会走向死亡的边缘。
-英国《每日邮报》近日对70年后,人类的生活将会有什么变化做了预测。文中写道:2083年,随着科技的进步,将出现不会衰竭的人造器官、具备超人般能力的仿生电子眼耳……
-据英国《每日邮报》网站8月12日报道,美军目前正在利用基因改造等技术打造“未来战士”。这种战士不仅可以连续数天不吃不睡,而且其部分器官还具有再生功能。
-英国退役军官、小说家西蒙·康韦披不久前曾参观过美国国防高级研究计划局(DARPA),他于近日向记者爆料称,DARPA正在研发一种机械外骨骼,士兵“穿上”它之后奔跑速度和负重能力都会大大提升。
-康韦披还说,除了借助机械手段打造“未来战士”,DARPA也在积极利用基因技术赋予“未来战士”超级能力。目前,该部门的研究重点项目之一是力图找出并激发可以让脂肪直接转化为能量的基因,从而使战士们在战场上可以连续数天不进食。对这一领域颇有研究的美国亚利桑那大学的霍埃尔·加罗教授也十分确定地表示,美军的确正在进行该项研究。
-美军目前耗资巨大、最具有科幻色彩的项目则是断肢再生项目。DARPA的军事科学家们通过研究儿童断指重生案例,正积极寻找控制人体器官再生的生理“开关”。

电影《终结者》中的未来战士造型。
-目前,3D打印人造器官技术越来越完善,实验室培养人体器官技术也越来越成熟,未来人类移植人造器官将不再是科幻小说中描述的画面。
-那些饱受疾病的人可以利用人造器官延续自己的生命,给自己和家人赢得幸福的机会。同样,那些拥有金钱权势的人也可以用人造器官实现长生不老的梦想。
-然而,到时候,我们是否要重新分配社会资源呢?
-在有限的机会中,占据社会高位的人自然可以获得更长的寿命,他们更有可能成为半人半机器的“仿生人”,那么,那些出生贫寒,机会原本就很少的人是否要被这些仿生人统治呢?
-这样的未来会更美好吗?
全套的人造器官配上一个200岁高龄的大脑,出现的
是生命的奇迹,还是地球的灾难?
- 那我们很快会有的下一个新话题,就是“如何迎接机器变人类的未来?”

“组织疗法”由苏联医学家弗·彼·弗拉托夫(Bладимир Петрович Филатов 1875-卒年不详)发明。他原是一名眼科医生,1897年大学毕业后一直从事角膜移植的研究和临床。此疗法的发明即源于一次偶然的、将冷藏过的角膜进行的移植手术,以及接下来的冷藏皮肤移植治疗狼疮患者的手术。据此提出了”生原性刺激学说“。
此学说认为:无论是人还是动植物的组织,与活体分离后,若置于其生存不利的条件下,该块组织由于环境变化,为了生存斗争,会发生一种生物化学改变,产生被称之为”生原性刺激素”或”抵抗素”的新物质,使其能在不利条件下继续维持生存。并设想若移植、置入或注射到人体内将发挥伟大的作用,能刺激提高病人生活机能,促进新陈代谢,增强再生能力。
在上世纪一切向苏联学习的情况下,这种疗法被介绍到我国,并迅速推广。由于当时的历史条件限制,其技术和理论还不完善,甚至存在误区,所谓的“生原性刺激素”或“抵抗素”也可能是子虚乌有,但还是给如今再生医学及相关生物材料的发展提供了积极的参考。
国内上世纪五六十年代出版了数十本有关”组织疗法”的书籍(如1951年上海新亚书店出版的组织疗法概说,钱春绮编)。现代人如何批判的学习”再生医学”的发展史,舍其糟粕,吸取精华,方可使医学的天方夜谭变为现实的医疗技术。


钱春绮编著的《苏联医学上的伟大发明·组织疗法概说》,由上海新亚书店1951年6月出版。
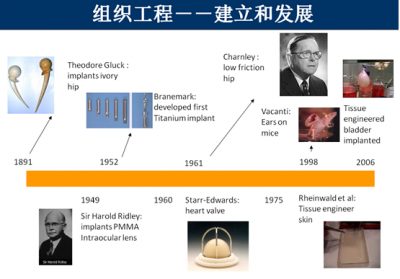
近二十多年来,组织工程得以建立和迅速发展。人们已经或正在构建具有生物活性的各种组织工程人工组织,如组织工程人工软骨、骨、皮肤、血管乃至人工肝等,并正在努力将这些”人工组织”植入人体,完成修复、替代病损组织的结构与功能。组织工程的发展和应用不仅可以减少伤残,挽救或延长生命,更重要的是,它标志着”再生医学”新时代的到来,是一场意义深远的医学革命 。毫无疑问,随着生物工程技术的发展,将会赋予组织工程更为丰富的内涵。
组织生长发育过程中,不同的细胞是通过一定的机制聚集并分化形成有功能的组织。组织工程的原理是在对细胞进行体外培养的过程中,用工程学的方法和手段操纵这一过程 。一旦组织可在体外大规模构建,即可直接应用于急需新组织的患者,这是一种理想的治疗理念。
组织工程学 (Tissue Engineering)诞生于八十年代末九十年代初,是一门利用工程学和生命科学原理 ,以人工合成材料为载体整合被分离细胞 ,并能在宿主体内降解释放细胞 ,形成新的有功能组织的科学(Vacanti CA, Vacanti JP, 1994)。 组织工程是生物医学工程领域中一个快速发展的新方向。这门交叉学科的核心是应用生物学和工程学的原理和方法来发展具有生物活性的人工替代物,用以维持、恢复或提高人体组织的功能。因此,这种治疗模式不同于目前生物工程中占主导地位的基于蛋白质及重组DNA技术的第二代治疗方式,而属于新兴的第三代基于细胞的治疗方式(McIntire LV,1992)。
总的说来,这一过程的发展依赖于工程技术解决问题的技巧。除用于于临床治疗外,工程组织还可以广泛地应用于需要哺乳类动物组织作为对象的基础研究体系。应用人工软骨培养系统,可在体外对关节炎的发生过程进行深入的研究(Schultz O, 1997);应用组织三维培养系统,可研究肿瘤侵润和病毒侵袭过程(Ingram M,1997);特别是工程组织还可用来生产内源药物,以及作为药物试验的体外模拟系统,从而将组织工程技术与制药业直接联系在一起。
组织/器官的原位再生是指通过一定的手段,如干细胞、生物支架、生长因子或药物等因素的其中一种或两种以上方法结合,通过注射或植入,于病损局部刺激或激发周围正常细胞的功能,诱导和促进组织的再生和功能恢复。这一方法除了要求设计、制备新型生物活性材料以提供细胞粘附和生长的基质外,通常还需要生长因子等的辅助作用。
相对于传统的组织工程方法,原位再生技术则是充分利用了人体自身的再生潜能,主要是一些干细胞性质的前体细胞。从组织工程学角度的定义,这种方法相当于“体内组织工程”或所谓的“内科组织工程”(‘internal medicine’tissue engineering)。
当然,“内科组织工程”提出时,仍然具有局限性。“内科组织工程”是指需要应用由蛋白质或基因组成的药物来促进刺激自然组织原位再生的一项技术。毫无疑问,DDSs技术被认为在这一方面将发挥主要作用。除了药物释放,DDSs技术也可延长药效并靶向药物至某一部位。例如,DDSs技术可通过把某一药物靶向至需要的部位以帮助体内组织再生并延长其在体内药效时间。
这一技术基于的原理是灵长类的组织再生能力并不都次于那些较低级的动物。一旦发生创伤,通过形成过量的纤维样组织(瘢痕)逐步得以修复,并最终抑制了自然组织再生。这一组织学现象通常见于纤维化疾病。若这种纤维化被抑制,或形成的纤维组织被排除,自然组织可望于治疗部位再生。
这种方法不仅可对纤维化疾病进行彻底的治疗,还有利于其后自然组织再生。据报道,在博莱霉素诱发的鼠肺纤维化疾病中注射肝细胞生长因子可抑制纤维化改变(Yaekashiwa M,et al,1997) 。
我们认为,原位再生技术应该是指可应用的一切生物学、材料学或医学手段,最终以引导或诱导组织/器官原位再生修复为目的,达到形态、结构和功能恢复的一项再生医学新技术。原位再生不仅能够修复损伤组织,还能实现全部或部分的功能恢复,是目前临床能够实现的、非常有效的一项再生医学技术和方法。
再生医学材料是指可引导或诱导组织再生,用于修复病变或缺损组织,使其功能恢复的一类生物活性可降解材料或替代材料。这类材料可以是天然衍生材料,如胶原、壳聚糖、煅烧骨、珊瑚等,也可以是人工合成材料,如有机高分子、无机陶瓷、金属合金等等。
用于再生医学的材料首先是生物材料,对人体无毒副作用,不致突变、畸变和癌变;可与人体组织和平共处,如无免疫排斥性和不产生明显炎性反应。同时,它又不是普通的生物材料。普通生物材料没有组织再生诱导能力,无法对缺损组织实现再生性修复。
理想的再生医学材料:1)应该是生物材料中的佼佼者,具有适宜的物理化学性质及特定的结构和功能,如可粘附相应的组织细胞及携带生长因子、多肽等生物活性物质;2)能够诱导细胞的增殖和定向分化,促进细胞合成和分泌修复组织所需要的胶原等细胞外基质;3)能够引导新生细胞按组织原有的多维结构进行重建,实现功能恢复。
【更多内容】
-
古代最原始的再生医学材料-植物和矿物的混合制剂
- 在古代,严重的穿透伤、多发性骨折、脊髓压迫、眼部损伤等具有很髙的发病率和死亡率。在古埃及、古中国、古印度、古印加等古代文明社会中,如何促进伤口愈合和外科手术的方法成为医学研究的焦点。
- 在这些古文明中,伤口的清创术已经成为常规操作,许多植物和矿物的混合制剂被局部用于治疗伤口,蜂蜜和酒被作为抗生素使用。
-
再生医学材料的雏形-一些天然材料的使用
- 公元前约3500年古埃及人就利用棉花纤维、马鬃作缝合线缝合伤口。墨西哥的印地安人(阿兹台克人)使用木片修补受伤的颅骨。公元前2500年前中国、埃及的墓葬中就发现有假牙、假鼻、假耳。
-
希波克拉底与再生医学
- 新的再生医学材料的发现和发展是出于创伤外科等医学技术发展的需要,同时推动了医学技术的发展。
- 希波克拉底(Hippocrates,460—370 BC),被称为“医学之父”的古希腊著名医生。通过骨折断端对接而使断离的软组织和骨折断端愈合。
- Celsus(25BC-50AD)和Galen(130-201 AD)等古罗马学者在医学发展史上,尤其是创伤的治疗方面,都具有重要的地位。归纳了炎症反应的4大特点:红、肿、热、痛。Galen作为角斗场的外科医生在负责治疗角斗士的伤口中积累了大暈治疗创伤的经验。并把解剖、生理和医学方面的知识汇编成书(虽然很多认识在现在看来是错误的),被翻译成阿拉伯、拉丁文等,成为中世纪医学领域主要指导书。
- 最早的人工材料-黄金等金属材料
- 人类很早就用黄金来修复缺损的牙齿。文献记载1588年人们用黄金板修复颚骨。1775年,就有用金属固定体内骨折的记载,1800年有大量有关应用金属板固定骨折的报道。1809年有人用黄金制成种植牙齿。1851年有人报道使用硫化天然橡胶制成的人工牙托和颚骨。
聚乙交酯(聚羟基乙酸,PGA)
聚乙交酯(PGA)是乙交酯(GA)的均聚物,是20世纪50年代初合成出来的最简单的线型脂肪族聚酯、也是最早应用于临床的合成可降解高分子材料。
其特点是高结晶度(45~55%)、高熔点(220~225℃)和高玻璃化温度(35~40℃),不溶于大部分有机溶剂,只溶于高氟化的有机溶剂如六氟异丙醇。但可以通过挤出、注塑和模压等方式加工成型。
PGA具有良好的成纤性,而高结晶度使其纺制的纤维具有很高的抗张强度和弹性模量。1969年Davis和Geck公司首先开发出商品名为Dexon的可吸收外科手术缝合线,并被美国FDA批准上市,成为第一款商品化的合成可吸收缝合线。
但由于PGA降解速度较快,Dexon的机械强度衰减很快,2周后其强度损失50%,4周后就几乎没有任何机械强度,4~6月其碎片完全被体内吸收,因此,一般只适用于2 ~4周愈合的伤口缝合[32]。
因为PGA具有合适的降解性、优良的初始力学性能和生物活性,PGA无纺纤维和无纺布被广泛作为组织再生支架材料,用于软骨、骨、皮肤、神经等组织的再生研究。
另外,PGA硬脑膜替代品也在研究中,因为它具有帮助组织再生和在无缝合线下闭合皮肤的能力。PGA具有优良的力学性能,在临床上使用的可降解高分子材料中,自增强PGA是最硬的,它的模量接近12.5GPa。因为良好的初始力学性能,PGA也被开发为内固定系统(Biofix®)。
PGA通过链段中酯键的随机断裂(水解作用)实现降解。在水解作用下,PGA在1~2月内发生力学性能下降现象,6~12月内发生质量损失现象。在体内,PGA降解成甘氨酸,甘氨酸可以通过尿液直接排出体外或代谢成二氧化碳和水。
虽然PGA亲水性较好,具有较高的细胞担载密度,但其存在难溶性和高熔点,高降解速率,降解产物呈酸性导致的细胞毒性等等问题,大大限制了其在再生医学和药物控制释放中的应用。不过这些问题可以通过与其它单体共聚获得改善。
聚丙交酯(聚乳酸,PLA)
PLA的合成与应用研究开始于50年代。70年代合成了高旋光性的高分子量D型或L型PLA,并开始了药物制剂和外科方面的应用研究;同时各种共聚物的合成弥补了单靠分子量及分布对降解速度调节的不足。80年代及90年代后随着应用领域逐渐扩大,尤其在生物医学工程领域的扩大,对其合成机理、结构性能、合成方法等研究也日趋深入,并且各种PLA产品相继出现于国际市场。
合成PLA的单体是乳酸(CH3CH(OH)COOH)。乳酸,又名二羟基丙酸,是自然界和动、植物体内常见的一种有机酸,来源非常丰富:在自然界中,由动物、植物、微生物在无氧条件下产生;可以通过简单的化合物——乙醛和乙醇——制得;也可以从石油(乙烯)和煤(乙炔)得到。
PLA可以由乳酸直接缩聚得到,也可以由乳酸的二聚体——丙交酯开环聚合制得。其中丙交酯的制备是先缩聚乳酸得到低分子量的PLA,然后在高温、减压条件下解聚,生成丙交酯,再经蒸馏和重结晶提纯[30]。乳酸是最小的手性分子之一,可以分为L(+)和D(-)两种旋光异构体。因此,PLA也有右旋PLA (d-PLA )、外消光PLA (d,l-PLA)和左旋PLA (l-PLA )、非旋光性PLA (meso-PLA)几种不同旋光性聚合物。
常用易得的是聚消旋乳酸(PDLLA)和聚左旋乳酸(PLLA),分别由乳酸或丙交酯的消旋体、左旋体得到。PLA的构型不同对聚合物的机械、物理和降解性能有很大的影响。
结晶性对PLA材料力学性能和降解性能(包括降解速率、力学强度衰减等)的影响很大。PLLA是具有光学活性的有规立构聚合物,是与PET性能相近的热塑性结晶高分子,熔融、溶液状态均可结晶,结晶度60%左右,其Tg和Tm分别为58℃、175℃;但PLLA性脆,抗冲击性差。PDLLA是无定形非晶态,Tg为58℃,力学强度明显低于PLLA。PLA的降解速度随着结晶度升高而变慢:PDLLA材料在生理盐水中降解,分子量半衰期一般为3-10周,PLLA至少为20周[31]。
分子量是决定PLA力学性能和降解性能的另一主要因素。分子量增大,PLA的力学强度提高。作为材料使用的均聚物分子量至少要达到10万。PLA热稳定差,即使在低于熔融温度和热分解温度下加工也会使分子量大幅度下降。但分子量升高,材料的降解速度也会变慢。
PLA类材料的一个突出优点是能用多种方式进行加工,如挤出、纺丝、双轴拉伸。加工过程中分子定向不仅会大大增加力学强度,同时使降解时间变慢。由于乳酸和羟基乙酸都是体内三羧酸循环的中间代谢物,且吸收和代谢机理已经明确并具有可靠的生物安全性,因而PLA和PGA及其共聚物作为第一批可降解吸收材料被美国FDA批准用于临床,是迄今为止研究最广泛、应用最多的可降解生物材料。
由于PLLA具有高拉伸强度、低断裂伸长率和高拉伸弹性模量(接近4.8GPa)等特性,因而是理想的医学固定和承重材料,如骨科固定器械和手术缝合线等。现在市场上的PLLA骨内固定器械有BioScrew®,Bio-Anchor®,MeniscalStinger®等。
另外,PLLA也可制成高强度的手术缝合线。1971年,PLLA手术缝合线经美国FDA批准上市,它具有比DEXON®更加优良的性能。PLLA也可用于其它一些医疗领域,如韧带修复与重建、药物洗脱支架、靶向药物运输等。
PLA通过链段中酯键的随机断裂(水解作用)实现降解,初级降解产物为乳酸,乳酸为人体正常代谢的副产物,通过柠檬酸循环,乳酸可进一步降解为二氧化碳和水。在水解作用下,PLLA在6个月内出现力学性能下降现象,但要经过很长的时间后才会出现质量损失现象。
因此,为了获得更好的降解性能,研究者将L–LA与GA或DL–LA共聚。Resomer®LR708便是一种由L–LA与DL–LA(质量比70∶30)共聚得到的无规共聚物。PDLLA因为L–LA和D–LA的随机分布形成了无规共聚物,Tg在55~60℃之间,强度大幅下降,这是由分子链的无规排列造成的。
在水解作用下,PDLLA在1~2个月内出现力学性能下降现象,在12~16个月内出现质量损失现象。与PLLA相比,PDLLA具有低强度和高降解速率的特点,是药物运输载体和组织再生支架(低强度)的理想材料。
聚己内酯(PCL)
聚(ε-己内酯)(PCL)是一种由ε-己内酯(ε-caprolactone)单体开环聚合而成的线性脂肪族聚酯,为半结晶态聚合物,结晶度为45%左右。
PCL最突出的特征是超低玻璃化温度(Tg=-62℃)和低熔点(Tm=57℃),在室温下呈橡胶态,是一种理想的弹性体。PCL的可加工性好,易溶于很多有机溶剂。
而且,PCL具有很好的热稳定性,分解温度为350℃,其它聚酯的分解温度一般为250℃左右;PCL的拉伸强度很低(23MPa),断裂伸长率很高(700%)。
PCL及己内酯单体都具有良好的组织相容性,在体内可水解降解,但降解速度比PGA和PLA慢得多。PCL在体内完全吸收和排除的时间为2~4年,且分子量越大,吸收时间越长。还可与多种高分子共聚。PCL的这些特性使其在药物控制释放及组织工程支架方面具有潜在的应用前景。
H.Tseng等采用3种不同的方法增加PCL的亲水性,之后与聚乙二醇(PEG)共混制成各向异性水凝胶纤维支架,该支架具有良好的生物相容性和可控性的结构,是一种潜在的心脏瓣膜组织工程支架材料。
由于PCL的降解速度很慢,为了获得较快的降解速率,研究者已经开发了几类含有PCL的共聚物。将ε-CL与DL-LA共聚可获得更快的降解速率,同样,ε-CL还可与GA共聚制成手术缝合线,它的硬度比PGA小,单丝缝合线MONACRYL?便是这样的一款产品。
另外由ε-CL,LA,GA和PEG组成的多嵌段共聚物可应用于药物控释系统,它主要作为中小型生物活性分子的载体(SynBiosys®)。
聚乙交酯–丙交酯(PLGA,LA与GA共聚物)
PLGA是LA与GA的共聚物。由于LA和GA的降解速率存在明显区别,因此可以通过调节LA与GA的投料比而获得不同降解时间的共聚物。研究发现,LA与GA的质量比在25/75~75/25时,PLGA为无规共聚物。R.A.Miller等的研究表明,LA与GA的质量比为50/50的PLGA具有最快的降解速度。
不同单体质量比的PLGA已经广泛应用于临床。商品名为Purasorb®PLG的PLGA便是一种半结晶共聚物,其中LA与GA质量比为80/20;多股缝合线Vicryl®中L–LA与GA的质量比为10/90,它的升级版VicrylRapid®也已经上市,经过辐照后的升级版降解速度更快;
PANACRYL®是另一种商业化的PLGA缝合线。另外PLGA也应用于其它医疗方面,如网丝(VicrylMesh®)、植皮材料和硬脑膜替代品等,组织工程植皮便是使用了VicrylMesh®作为支架材料。
PLGA中的酯键因水解作用断裂,其降解速率受很多因素影响,如:LA与GA质量比、分子量、材料的形状和结构等。PLGA具有易于加工和降解速率可控的特点,被美国FDA批准可应用于人体,在可控药物/蛋白运输系统、组织工程支架等领域得到广泛研究。
作为药物载体和靶向释放,PLGA能够以微球、微囊、纳米球和纳米纤维等多种形式存在,药物的释放参数可以通过调节PLGA的性能加以控制。因PLGA是整体侵蚀降解,即表面和内部同时降解,所以它很难达到零级释放的效果。
同时,PLGA的易加工性能及支持细胞粘附和生长作用,使它具有潜在的组织工程和再生医学应用性,很多研究已经制备了微米–纳米级PLGA三维支架。而其体内可降解性和降解速率可调的特性,使其普遍适用于人体不同组织、器官的再生与修复需要。因此,PLGA是一种理想的再生医学材料。
再生医学材料无论是作为体外的组织/器官支架,还是应用于体内组织/器官的再生修复,往往需要具备一定的三维(3D)空间结构。具有特定形状和微观结构、合理孔尺寸和孔隙率的3D支架,能够满足特定组织/器官的重建需要,可为细胞的附着、迁移、增殖、分化以及新组织的形成提供空间支持。孔隙太小,细胞无法进入孔隙或阻碍细胞增殖和扩增;孔隙太大,则细胞无法粘附和聚集,失去支架的作用。因此,支架的制备技术与工艺对于材料的生物医学应用至关重要。
传统3D支架的制备方法多种多样,每种方法均有各自的特点,但没有一种方法能同时满足所有组织的要求。针对目前3D支架存在的问题,人们正在研究开发新的制备和加工方法,以获得更加理想的支架材料。如近几年刚刚兴起的气体发泡和支架打印,可望为制备新一代的智能型再生医学3D支架(组织工程支架)提供技术支持。
(1) 纤维粘结法
以PGA纤维无纺毡作为支架材料是组织工程中最早采用的一种方法。作为一种经典的支架材料,目前仍应用于组织工程研究中的各个方面,尤其是有关生物反应器、生物力学模型等方面的研究。PGA无纺毡是经熔融挤出、取向、切梳、针刺等工艺加工成型而得到的。PLGA纤维构成的骨架的优点是表面积大,有利于细胞的粘附和养分的扩散,故对细胞存活和生长有利;缺点是内架结构稳定性不好,其孔的尺寸较大,孔隙率、比表面积不可控。因此,有必要对此加以改进,将无纺毡中互不相连的纤维粘结起来。连结纤维的方法主要有两种。
一种是Mikos等[35]发明的纤维固定技术。将PGA纤维浸入到PLLA的氯仿溶液中,待溶剂挥发后,PGA纤维网嵌入到PLLA中,将混合物加热至两种聚合物的熔点以上。由于熔点不同,PLLA首先熔融,充满PGA纤维网络所有空隙,其作用是稳定PGA纤维和防止PGA熔融时纤维网络结构塌陷。继续升温,PGA纤维熔融后于交叉点处粘结在一起。选定一种只能溶解PLLA的溶剂(如二氯甲烷),将其溶解除去PLLA,即可得到高度多孔的PGA网状支架。此方法获得的孔隙率和孔径一般分别高达81%和500μm。
另一种方法是通过雾化或喷雾对纤维表面进行涂层[36]。由于氯仿不是PGA的溶剂,以喷雾方式将PLLA或PLGA氯仿溶液喷涂到PGA纤维网表面,而PGA纤维结构不会发生变化。溶剂挥发后,PGA纤维由PLLA或PLGA在交叉点处粘结起来。这种复合结构综合了纤维的力学性能和PLA的表面特性,其孔径与前一种方法相近。
纤维粘结技术制备的多孔支架,特点是孔隙率高,孔与孔之间连通,具有一定力学性能,适用于组织再生。缺点是需用到有机溶剂,第一种方法还需要高温加热。有机溶剂的残留及高温过程对引入生长因子类的生物活性分子和细胞是非常不利的。
(2)溶液浇铸/粒子沥滤法
溶液浇铸/粒子沥滤技术是继PGA无纺织物支架之后的另一种传统的多孔支架制备方法。其优点是通过选择一定粒径分布的水溶性粒子和调节粒子与聚合物的比例,可形成孔径和孔隙率可控的聚合物骨架。致孔剂通常为盐(NaCl等)或糖(蔗糖等)等可溶性粒子。
方法是将聚合物(PLLA或PLGA)溶解在CHCl3或CH2Cl2 中,然后将溶液浇铸到充满致孔剂的培养皿上。待溶剂挥发后,将聚合物/盐混合物在水中沥滤两天以去掉致孔剂,从而得到不含粒子的聚合物骨架。
骨架的孔隙率由所加盐的用量来控制,孔的直径由盐晶粒的大小决定[28]。通常当盐的重量百分比达到或超过70 %时,孔与孔之间高度相互连通。然而,泡沫暴露在空气中的外侧部分比浸润在陪替氏培养皿中的部分粗糙,即两部分具有不同的形态,故采用该技术不能制备太厚的骨架,一般在2mm以下。对此的改进是将块状的聚合物/盐混合物在高于PLLA的熔点或PLGA的玻璃化温度上模压成圆柱体形状,在混合物用水沥滤之前,将圆柱体切割成所需厚度的片状,片状的聚合物/盐复合体经水沥滤后,采用层叠技术将片状骨架叠在一起,从而可更为精确地控制支架的厚度和提高泡沫表面的规整性。然而,需考虑模压过程中聚合物的热降解问题。
这种方法的缺陷是往往存在闭孔结构和盐/糖粒子残留等问题,这对细胞的生长不利。为此,Chen等[37]采用冰晶作为致孔粒子,将粒子沥滤与冷冻干燥法相结合,发展了一种新的多孔支架制备方法,获得了高孔隙率的PLLA多孔支架,并避免了盐/糖粒子残留对细胞生长的影响。其孔结构分布均匀且互相连接。然后,PLLA支架进一步与胶原复合,经戊二醛交联后,获得了一种PLLA孔内含有胶原微孔海绵的复合支架。
为避免残留的溶剂对细胞产生毒性影响,Jung等[38]将上述的溶液浇铸法改为烧结法(sintering)制备了多孔支架。具体方法是:采用30-40mm的PLA粉末与NaCl粒子混合,在模具内先以150Mpa室温下挤压3min,然后以稍高于PLA熔点(190℃)的温度(210℃)继续挤压30min,冷却后水浸沥48h去除盐粒子,每6h更换1次水。与溶液浇铸法比较,所制备的多孔支架孔尺寸更均一,力学性能明显增强。
(3) 相分离/冷冻干燥法
相分离/冷冻干燥法是指聚合物溶液、乳液或水凝胶在低温冷冻过程中发生相分离,形成富溶剂相和富聚合物相,然后经真空冷冻干燥除去溶剂而形成多孔结构的方法[39]。按体系形态的不同可简单地分为乳液冷冻干燥法、溶液冷冻干燥法和水凝胶冷冻干燥法。其特点是:1)避免了高温,有利于生物活性分子如蛋白质生长因子或分化因子的引入和控制释放;2)孔比表面积大,易操作;3)通过调整油水比、聚合物分子量来控制孔结构。支架孔隙率可达90-95%,孔径范围在0.01-200um[40]。
(4) 超临界CO2气体发泡法
超临界CO2气体发泡法,是指将聚合物挤压成型(块或片),浸泡在高压二氧化碳中直至饱和,甚至超临界状态,然后迅速降至常压,气体的热力学不稳定性导致气泡成核和增长,形成多孔支架。
该方法的优点是:1)避免了在制备聚合物支架时使用有机溶剂;2)还可避免使用高温,有利于在温和的条件下引入生长因子。
发泡法中影响孔隙率和孔结构的因素主要有聚合物结晶性和分子量、平衡时间、放气速率等。结晶性聚合物PLLA和PGA难以发泡,无定型聚合物PLGA易发泡,孔隙率最高可达95%;聚合物分子量越高越难以发泡,孔隙率越低;在高压气体中平衡时间越长,孔隙率越高;放气速率对孔隙率影响较小。血管发生生长因子,如血管内皮细胞生长因子被相继复合入PLGA,并以可控的方式释放。尤其重要的是,被释放的生长因子的活性保持在90%以上[41]。
除了CO2,氮气(N2)和氦气(He)也被尝试用于聚合物发泡,但均未能成功。缺点是闭孔结构较多,孔隙率与孔径均偏小[42]。若将发泡法与粒子浸出法相结合,则可制得相连的开孔结构的多孔支架[43]。
(5) 化学发泡法
制备多孔支架的另一种方法即化学发泡法。化学发泡剂主要为碳酸盐类化合物。将聚合物溶液与碳酸氢铵粒子混合至粘糊状并加入到模具内,待溶剂部分挥发后浸入热水中发泡,使氨和CO2挥发,最后经冷冻干燥可得到高孔隙率和互相连接的多孔支架[44]。
(6) 静电纺丝技术
静电纺丝是一种简便易行的新型组织工程多孔支架制备方法。电纺支架具有独特的微观结构和适当的力学性能,由于具有与天然ECM相近的纳米级结构,电纺支架能够仿生ECM的结构特点使之有望成为理想的组织工程支架。
电纺最早出现于1934年Formhals在美国的一篇专利中首次介绍了利用静电斥力获得聚合物纤丝的方法[45]。其原理是利用外加电场力使聚合物溶液或熔体克服表面张力在纺丝喷头毛细管尖端形成射流,当电场强度足够高时,在静电斥力、Coulomb和表面张力的共同作用下,聚合物射流沿不稳定的螺旋轨迹弯曲运动,在几十毫秒内被牵伸千万倍,随溶剂挥发,射流固化形成亚微米至纳米级超细纤维[46]。
目前已有超过100多种天然和人工合成高分材料被成功地电纺成纳米纤维,所得单根纤维的直径从40-200nm,甚至可以跨越10-104nm的量级,即从微米、亚微米直至纳米尺度范围,并用于组织工程研究[47]。
影响电纺丝的因素包括过程操作参数(电压、流速、接收距离及温度、湿度、空气流动速率等)和系统参数(聚合物分子量、分子量分布、分子链结构、溶液浓度、溶剂种类和配比、溶液的性能,如粘度、导电率、界面张力等)。由于电纺丝的孔尺寸较小,一般在100mm以下,甚至更小,细胞很难进入支架内。而且,电纺丝的热稳定性和力学支撑性均较差。
因此,人们正在尝试新的纺丝方法,以使其适合组织工程的需要,如将聚合物与水溶性高分子同时进行电纺丝制备复合支架,以求获得更大的孔径。
(7) 计算机辅助的快速成型方法
近年来,快速成型技术(Rapid Prototyping Manufacturing,RPM)用于组织工程支架的制备越来越受到人们的关注。
快速成型技术指首先经计算机辅助设计(Computer Aided Design,CAD)获得三维模型,然后根据工艺要求进行分层,将三维模型分割为连续的二维截面图像,通过不断重复堆积和逐层加工,一步获得同时具有预先设计的孔结构和外形的三维多孔支架。包括立体平板印刷(stereolithography apparatus,SLA),激光烧结(laser sintering, LS),层压技术(laminated object manufacturing, LOM),熔融堆积成型法(fused deposition modeling,FDM)和三维打印技术(three-dimensional printing, 3-DP)等。
通过这些技术,可以获得类似人体组织微结构和器官外形的支架材料和实现组织工程器官支架制备的个性化[48,49]。例如,对某一骨缺损患者,可先行X线或CT扫描,获得缺损部位的影像,经计算机CAD软件设计出三维骨模型,通过打印技术制备出特定尺寸和外形的骨支架,用于患者的骨缺损修复。
三维打印技术还可用于对支架进行选择性修饰来调控一些特殊类型细胞的三维空间分布,引导复杂组织的有序再生。为此,Park等采用打印技术,先将PLLA的表面经PEO-PPO共聚物修饰,结果肝细胞和成纤维细胞均不能在其表面粘附生长;然后,将针对肝细胞唾液酸糖蛋白受体的糖基配体通过共价方式连接到PEO链末端,出现了选择性地粘附肝细胞现象[50]。
材料的细胞亲和性
|
再生医学材料无论是体外应用(组织工程)还是体内应用(组织修复),都与组织细胞存在直接的相互作用关系。材料本身所具有的各种物理化学性质都会影响到细胞的粘附、扩展、迁移、生长、增殖和分化等诸多细胞行为,材料表现出的这种生物学效应,即所谓的细胞亲和性。因此,材料的细胞亲和性是材料生物学性能的综合体现,是材料能否用于组织/器官再生的首要性质。 1、什么是细胞亲和性? 细胞亲和性是指生物材料能让细胞在其表面粘附、生长及发挥正常生理功能的能力。材料对细胞的粘附能力、材料的毒性以及材料与细胞之间的分子识别是影响细胞亲和性的关键因素。 细胞与材料之间的相互作用,一般认为是由于细胞与材料之间存在着一种以蛋白质为介导的粘附机理、粘附特性的差异,故影响细胞的增殖、分化等功能。 除了材料本身的化学性质,由于细胞真正接触的是材料表面,因此材料的表面界面性质对材料的细胞亲和性有主要影响。 2、细胞粘附的基本过程 细胞粘附过程根据细胞特定的形态改变可分为四个连续发生并相互重叠的变化时相,即细胞附着(cell attachment)、细胞伸展(cell spreading)、肌动蛋白细胞骨架(actin cytoskeleton)的组织以及焦点粘附(focal adhesion)的形成[53]。 首先,细胞附着在几秒或几分种内完成,涉及细胞/材料间物理——化学联系诸如离子力、范德华力等短期事件(short-term event);附着的细胞与基质蛋白结合紧密,不易被冲走。 很快进入细胞伸展相,附着的细胞变平,细胞膜在基质表面伸展,呈现各种细胞本身特有的形态。 接着,肌动蛋白进人微丝束,形成肌动蛋白细胞骨架[54]。 焦点粘附又称焦点连接或粘附斑,是高度特化的、专有的细胞结构,构成脑外基质分子和骨架蛋白的联系,对细胞骨架的募集起重要作用,并介导跨膜信号转导,激活转录因子及后续调节基因的表达[55]。 由此可见,细胞粘附涉及多种生物分子,包括细胞外基质蛋白、细脑膜蛋白以及细胞骨架蛋白的相互联系和相互作用。 3、细胞粘附的影响因素 细胞和材料的粘附是一个多因素的复杂过程,受多种因素的影响,主要有细胞生物学因素和材料因素两个方面。 细胞生物学因素包括细胞的活力、细胞膜的荷电性质、细胞的亲疏水性、细胞膜表面分子的侧向运动、细胞膜的柔韧性、细胞与材料的接触时间等。 材料因素主要是指材料的化学结构、材料表面的亲疏水性、表面自由能、表面荷电特性、几何形状以及材料的降解活性等。都对细胞粘附起关键性作用。另外,细胞与材料所处的环境,如酸碱性、温度、机械负荷及作用的时间等,都不同程度地影响细胞与材料的粘附[56]。 4、如何改善材料的细胞亲和性 在细胞粘附过程中,材料的理化性质和表面特性起关键性作用。通常可以通过以下方式改善材料的细胞亲和性:
5、展望 合成聚合物绝大多数亲水性差,细胞粘附力弱,需要进行必要的包裹和表面修饰,以提高表面生物活性,有利于细胞在材料上的粘附,进而影响细胞的迁移、增殖和分化[58]。 如何有目的的进行材料的表面修饰以利于细胞粘附、增殖及分化,是组织工程要解决的基本问题。 目前,广泛应用的表面修饰方法包括材料表面包被、铰链某种蛋白或短肤及改变表面的几何形状如粗糙度等等。材料的表面修饰是涉及多学科、多领域的复杂工程。 目前可作为材料表面修饰的蛋白主要是粘附蛋白(或相关肽)和生长因子(或相关蛋白)。在一定的条件下,RGD肽合成方便、功能强大,有望成为改善生物材料表面活性的关键因素。对于骨再生医学材料,联合应用BMPs可提高成骨细胞的矿化能力的生长因子,可显著提高细胞的粘附及其功能。 因此,随着该领域研究的深入,必将使我们有目的的对材料表面进行修饰改性,开发出理想的、适合不同细胞或组织生长需要的再生医学材料。 |
7、人类新希望:再生医学(视频)
皮肤是人体最大的器官,总重量占体重的5%~15%,总面积为1.5~2平方米,厚度因人或因部位而异,为0.5~4毫米。皮肤覆盖全身,在生理上起着重要的保护功能:一方面防止体内水分,电解质和其他物质的丢失;另一方面阻止外界有害物质的侵入。另外,皮肤还具有感觉、调节体温、呼吸、代谢等功能。
皮肤作为人体最大最外部的器官极易遭受创伤。各种急、慢性创伤千百年来一直困扰着人们,因此也一直是医学领域的研究热点。其中烧伤或烫伤极易造成大面积不同程度的皮肤损伤,患者往往由于体液丢失、感染导致休克甚至死亡,是目前临床治疗的难点。
大多数患者烧伤面积小于总体表面积(TBSA)的40%,这些患者可以从未烧伤部位取得含表皮和真皮的游离厚皮(自体移植物)进行移植修复。烧伤面积达60%的患者,也可在供皮部位表皮化后重复取皮以用于移植。然而,这种”以伤治伤”方式存在感染、疤痕和色斑等不良后果。尤其是大面积烧伤患者在有限的供皮区反复取皮会加重疤痕形成和色素改变,严重影响功能和外观 [44]。对于烧伤面积大于60%的患者,则无法仅以自体移植物进行覆盖修复。
对于年幼或老年患者,及同时患有系统性疾病或烟雾吸入性损伤患者,烧伤后的 治疗更为困难[45,46]。这些患者对大的开放性损伤耐受性差,更易感染、导致败血症,甚至死亡。因此,需要寻找一种皮肤替代物以永久或暂时覆盖创面,以减少对供皮区皮肤的损伤。
采用组织工程技术,将皮肤细胞与人工材料结合,能够制备出具有活细胞成分、类似于皮肤结构和功能的工程化人工皮肤。这些新型的创面覆盖物对于移植物缺乏的大面积烧伤病人或难愈合的慢性溃疡病人的皮肤修复具有重要意义。随着材料学技术和干细胞技术的不断进步,未来的工程化活性皮肤将有可能替代自体皮移植,给人类皮肤损伤的治疗带来福音。
【研究进展】
皮肤作为人体最大最外部的器官极易遭受创伤。各种急、慢性创伤千百年来一直困扰着人们,因此也一直是医学领域的研究热点。其中烧伤或烫伤极易造成大面积不同程度的皮肤损伤,患者往往由于体液丢失、感染导致休克甚至死亡,是目前临床治疗的难点。
一、皮肤的损伤类型与自我修复能力临床上将皮肤损伤分为3类:即表皮损伤(I°),表皮及浅层真皮损伤(II°),表皮及全层或接近全层真皮损伤(III°)。皮肤通常情况下具有一定的再生修复能力,而不同烧烫伤深度决定并影响皮肤的这种自我修复能力。 I°烧伤:表皮具有较强的再生能力,仅仅是表皮损伤(I°),可以通过角质形成细胞的迁移来实现修复。这些角质形成细胞是一类具有干细胞性质的皮肤上皮细胞,通常来自于伤口周围的正常组织,也可来自于伤口底部残留的基底层,或者附属器中的角质形成细胞的扩增。这些过程均可再生完整表皮,而不留红斑。 II°烧伤:真皮通常不能再生,烧伤造成的真皮缺损不易修复。当仅仅浅层真皮损伤,即II°烧伤,残存的较完整的真皮仍然可引导发生有效的表皮化,不会留下明显疤痕或挛缩。但创伤处的真皮将永久性薄于正常皮肤。 III°烧伤:深层真皮损伤或真皮全层缺损在功能上均属于III°烧伤。表皮附属器被破坏,即使残留少量真皮也不能再生。创口通过肉芽组织增生以抵抗细菌侵袭。肉芽组织内成纤维细胞过度增生产生大量的胶原,同时分化为具有收缩性的肌成纤维细胞。后者牵拉伤口边缘尽可能使伤口缩小,以便周围的角质形成细胞迁移,使伤口表皮化。多数情况下,当真皮缺损大于2cm时不能发生有效收缩,以致形成慢性非表皮化的开放创口。由于真皮不能再生,接近全厚或全厚损伤成为机体的真正缺口,若不进行外科治疗,无法自然修复。即使愈合也是通过收缩实现,其代价是影响周围皮肤和关节的形态和功能。 二、参与皮肤损伤修复的因素皮肤创伤修复依赖于细胞与细胞外基质(extracellular matrix,ECM)的相互作用。成纤维细胞(fibroblast, Fb)是主要修复细胞,在某些趋化因子的作用下,由创面周周向创面移位,并分泌大量的ECM如胶原蛋白(collagen)、纤维连接蛋白(fibronectin,FN)、层连蛋白(liminin,LN)[116,117]、体外黏连蛋白(vitronecftn,VN)、蛋白多糖(proteoglylans,PG) 等。Fb-ECM相互作用时,一方面Fb 增殖,合成分泌ECM成分填充缺损;另一方面,ECM起着支架和连接作用,并调节Fb的发育、移位和增殖。在某些细胞因子作用下,Fb过度增殖,致ECM异常沉积,则可形成增生性瘢痕或瘢痕疙瘩。 创伤修复包括受损组织的消除和各种细胞的聚集,局部产生大量的胶原基质,最后形成瘢痕。多种细胞、基质成分、血管及多肽生长因子都与创伤修复过程密切相关。 三、皮肤损伤修复的过程损伤修复的过程可分为:炎症、增生和重建三个阶段。这三个阶段是连续和相互重叠的过程,往往因损伤的部位、性质、范围以及是否伴有感染而有所不同。损伤修复的过程有共同的特点。 (一)损伤修复的炎症期炎症期是损伤修复的初始阶段,其特点是血液来源的细胞积聚在损伤部位、并释放一系列的细胞因子(cytokine)与介质(mediator)。急性损伤发生的同时,损伤的修复过程即已开始。损伤导致血管的破裂,红细胞外渗,血液中的其它成分也外渗到损伤部位。 1. 血小板凝集发生损伤以后,血小板是在损伤局部释放的凝血酶(thrombin)和暴露的纤维性胶原的作用下被激活,释放一些颗粒产物,并迅速发生粘附、聚集,沉积于损伤局部。血小板释放的纤维蛋白原转变为纤维蛋白,作为基质部分,以供参与损伤修复过程的单核细胞与Fb吸附之用。 另外,血小板还释放一些损伤修复必不可少的生长因子,如PDGF等。这些生长因子和单核细胞、Fb及其它特异细胞,在炎症发生和组织修复重建中发挥重要作用。其中,血小板衍生生长因子(PDGF)对Fb同时具有趋化因子和有丝分裂原的作用。在实验中,应用生理剂量以上的PDGF,可加速大鼠和兔子伤口的组织修复作用,并存在剂量效应关系。用PDGF于兔的伤口,愈合速度(3周)超过对照组成50-170%。 2.血液凝固血管内成分参与的血凝固和血栓形成过程是损伤修复早期阶段的重要步骤。血浆与血液中其它成分的渗出,通过内源性和外源性两种途径形成凝血酶,并将纤维蛋白原转变为纤维蛋白,从而引发凝血过程和血栓形成。形成的纤维蛋白性凝块不仅具有止血作用,而且可作为单核细胞、Fb、角质细胞移行与粘附的基质支撑物,以促进损伤的全面修复。 3.炎细胞浸润损伤修复过程的早期阶段是一典型的炎症反应过程,又称为炎症期,有一系列的血液中白细胞外渗到损伤的部位。其中,中性粒细胞是最先到达损伤位点的细胞类型。凝血链式反应中所产生的一系列趋化因子,如血管舒缓素、纤维蛋白多肽、纤维蛋白的降解产物,诱导血液中的白细胞以及单核细胞移行到损伤区域,同时介导细胞与细胞之间的结合。 在炎症阶段,血液中的单核细胞与组织中的巨噬细胞发挥着十分重要的作用。在细胞外的一些降解产物、凝血酶以及转化生长因子b(TGFb)等趋化因子介导下,单核细胞向损伤位点的迁移,离开血管进入组织,转变为巨噬细胞的组织表型。组织中的巨噬细胞合成与分泌PDGF、FGF、TGFb和TGFa等生长因子,对细胞迁移、增殖以及细胞外基质蛋白的产生都具有十分重要的调节作用。巨噬细胞也参与损伤位点的抗感染过程。 (二)损伤修复的增生期1. 上皮新生皮肤损伤修复最终结局,是形成皮肤结构这一天然屏障。在损伤的24小时之内,表皮对于皮肤缺损状态即产生应答,开始时,Kc从表皮的边缘向损伤部位移行。最先形成的基质部分由纤维蛋白、纤维粘连蛋白以及V型胶原蛋白组成,这些ECM成分可促进Kc发生进一步的迁移。移行中的Kc自身也表达纤维粘连蛋白,促进自身的迁移过程。 生长因子在迁移细胞的信号传导过程中发挥着十分重要的作用,主要有TGF-b和EGF等。在移行过程中的基底细胞可能选择性地表达一些细胞表面标志物,如CD44分子等。CD44分子在正常的基底细胞上没有表达,只在鳞状细胞上具有表达活性。因此,这些标志物的表达可以作为一种研究工具,以评价损伤修复早期阶段一些治疗措施的应用与效果。 2. 血管形成血管形成是指新血管的生长,或新形成血管。从损伤部位的血管,先形成毛细血管芽,然后再长入到损伤部位。首先,血管内皮细胞向损伤区移行进入到损伤部位,这是血管形成过程最为重要的一个步骤。完成迁移之后,再进行增殖反应。内皮细胞通过血管的形成,加强损伤部位氧及营养成分的运输,并分泌一系列生物活性物质,以促进损伤修复过程。在损伤修复过程中,由巨噬细胞释放的一些可溶性的因子,可以刺激血管形成过程。另外,低氧、乳酸浓度升高、生物产生的胺类,也是刺激血管形成的重要因素。低氧状态可刺激TGFb和胶原的合成,这也许是某些慢性损伤修复过程中出现纤维化的一个重要原因。FGF家族中的一些成员也是损伤修复过程中血管形成的有力刺激因素。其中bFGF促进血管形成的作用较aFGF的作用还要强得多。bFGF与肝素进行相互作用,以促进血管的生长。巨噬细胞与Fb是损伤修复过程中bFGF的两个主要来源。 3. 纤维组织形成正常有序的损伤修复过程最为普遍的特征即是颗粒组织的形成。修复过程中颗粒组织的形成包括新生的血管移行进入到损伤位点,之后血管内皮细胞开始增生、并出现Fb的不断积聚。产生皮肤基质最为重要的细胞是Fb。在损伤发生48~72小时之间,即有Fb向损伤位点的移行活动。Fb一旦到达损伤位点,即发挥一系列的生物学功能。 在酸性、低氧条件下,Fb处于旺盛的增殖状态,同时产生大量的细胞外基质蛋白,包括胶原、蛋白聚糖以及弹性蛋白等。在这一阶段,Fb的亚型发生改变,成为肌成纤维细胞。这种肌成纤维细胞在电子显微镜检查中,既有平滑肌细胞的特征,又有Fb的特征。这些细胞中含有大量的粗面内质网,说明具有合成大量基质蛋白的功能。另外,作为一种肌成纤维细胞,也参与损伤修复部位的收缩过程。 4. 损伤部位的收缩损部的收缩力来源于损伤部位的颗粒组织,这是由肌成纤维细胞合成的结缔组织蛋白,其中含有能够发生收缩的蛋白质成分。损伤部位的收缩主要是由富含肌动蛋白的肌成纤维细胞的收缩而进行的。肌成纤维细胞是颗粒组织中的主要细胞类型。在损伤部位的肌成纤维细胞沿收缩方向排列,而颗粒组织中其它类型的细胞成分,如白细胞和内皮细胞则不具备这种排列方式。在体外,肌成纤维细胞在受到血管紧张素、肾上腺素、去甲肾上腺素、5-羟色胺、前列腺素和缓激肽等的刺激时,则出现肌细胞那样的收缩。这种收缩是同时发生的,需要一系列的细胞一细胞之间、以及细胞与基质之间的相互作用机制的参与。 损伤部位的收缩功能与ECM中胶原蛋白和非胶原蛋白的含量与分布密切相关。其中,纤维粘连蛋白是非胶原蛋白中的一种,也参与损伤修复部位的收缩。在体外,纤维粘连蛋白分布于肌成纤维细胞的周围。损伤部位的收缩能力与损伤部位的面积大小及深度有关。损伤部位的收缩是损伤修复过程中一个重要的环节,而在某些解剖部位,可影响功能和外观,利用平滑肌的松弛剂可以抑制损伤部位的收缩过程。 (三)损伤修复的重建期损伤修复的第三阶段就是损伤修复的重建期,也是损伤修复的最后一个阶段,包括一系列细胞外基质蛋白的沉积和之后的一系列重新分布与调整。在损伤修复阶段,皮肤中的一些生物大分子,如纤维粘连蛋白、透明质酸、蛋白聚糖、胶原蛋白等发生沉积,形成骨架结构,便于其它细胞的迁移。细胞外基质蛋白的沉积与重建是一个动态的过程。损伤修复过程中,细胞外基质沉积的量和类型在周边部分和中央部分存在差别。 在皮肤的功能性屏障结构得到重建以后的很长一段时间里,修复过程一直在进行之中。在修复的早期阶段即有胶原蛋白的沉积,在损伤发生2~3周之后达到胶原蛋白沉积高峰。损伤发生1个月以后,其张力增加40%,这是胶原蛋白沉积的一个重要指标。在损伤发生以后的1年之内,其张力也不断增加。即使如此,修复以后的最大张力也不超过正常组织张力的80%。 在损伤修复的重建阶段,修复组织中胶原蛋白的含量和类型也有所改变。在损伤修复最初阶段,Fb分泌的胶原蛋白以Ⅲ型胶原为主。之后一年或更长的一段时间,逐步恢复到以I型胶原蛋白为主的状态。修复组织中,Ⅲ型胶原在特异性的胶原酶催化作用下逐渐降解,I型胶原逐渐合成,使以Ⅲ型胶原蛋白为主的结构方式,经过一个长期复杂的过程,逐渐转变为以I型胶原为主的结构方式。 |
皮肤替代物的发展,大致经历了三个阶段:从最早的天然生物覆盖物,到后来的合成材料替代物,直至近年来发展起来的具有细胞成分的组织工程皮肤。
1. 自体移植物
自体皮移植是目前烧烫伤患者最理想的、也是永久性修复创面的唯一方法。从患者身上未损伤的区域取得游离厚皮移植物(表皮连同薄层真皮)要优于任何其它方法,尽管如此,该方法仍存在不足:1)对供皮区造成新的创口,给患者带来疼痛;对于大面积烧伤患者,同时增加开放创口的数量诱发机体炎症反应等。2)供皮区易留下疤痕和色斑改变。3)供皮区真皮取走后不能再生,永久性地使该部位真皮较正常皮肤薄。4)供皮区成为微生物侵袭的潜在部位。5)供区不能无限制地提供真皮。6)对大面积烧伤患者,由于自体供皮不足,不能完全以自体移植物关闭创面。因此,往往需要同种异体或异种皮肤暂时覆盖创面[47-49]。
2 同种异体移植物
同种异体移植物来源于尸体皮,是一较理想的天然覆盖物[48,49]。人类尸体皮移植早已常规地作为暂时性创面覆盖物用于烧伤的治疗[50],它具有如下优点:1)防止创面干燥;2)肉芽组织生成;3)减少水分蒸发;4)减少热量损失;5)限制细菌增殖;6)防止渗出的蛋白及红细胞流失;7)减轻伤口疼痛;8)有利于受损关节的运动:9)保护暴露的肌腱、血管、神经;10)促进浅表烧伤的自愈过程; 11)具有良好的美容效果。尸体皮移植3天就有血管长入。但是紧接着3-4周内发生免疫排斥反应[51]。由于尸体皮属同种异体皮,其中的细胞成分是引起免疫反应的主要因素。如果去掉细胞成分,真皮就可以永久性地贴附于创面上,有利于表皮的移植。
3 异种皮肤移植物
早在1692年,有人曾尝试以水蛭皮护理伤口。而在巴西,青蛙皮曾被用于覆盖创面。进入20世纪后,人们陆续尝试以豚鼠、鸡、兔、狗及猪等动物皮肤治疗烧伤[54-56]。其中应用最广并延续至今的是猪皮。异种皮由于不能与宿主建立血管连接,并可发生免疫排斥反应,只能作为暂时覆盖物,以防创面感染和体液大量流失[51]。同时,异种皮移植,还存在感染”人畜共患传染病”的潜在风险。
尸体皮移植物和异种皮移植物作为暂时的天然皮肤替代物,均存在共同的问题――免疫排斥、疤痕和传播疾病等,以合成材料或合成材料与天然生物材料复合而发展起来的皮肤替代物,可用于烧伤的辅助治疗[57]。
为迅速闭合创面,皮肤替代物必须具备:1)能够粘附创口底部;2)耐磨并富有弹性,以防止变形;3)基底层水分丢失控制在一定的速率;4)提供生物屏障防止细菌侵袭;5)提高止血能力;6)应用方便;7)可于创伤后随时应用;8)能引导创口”再生样”反应,而不发生炎症、免疫排斥和自身免疫反应[2]。
Biobrane是一种透明的具有”表皮”和”真皮”结构的复合材料人工皮肤。顶层为类似于表皮的一薄层硅氧烷(Siloxane),真皮层为胶原包被的尼龙网,有延展性好,不易形成碎片等特征。目前已广泛应用于烧伤覆盖[58]。但Biobrane的应用有局限性,不能用于干枯和有坏死组织的创面,仅适于湿润且相对洁净的Ⅱ°烧伤创面和无菌的供皮区[59]。
二十世纪60年代末,Burke和Yannas开始尝试研制合成材料人工皮肤[60,61]。
Dermagraf-TC及Transcyte是一类与上述的Biobrane相似的人工皮肤覆盖物,不同的是真皮中增加了人成纤维细胞。有趣的是,无论成纤维细胞是活还是死,均具有同样的功能。临床试验表明,Dermagraf-TC完全可替代尸体皮移植物作为暂时的烧伤覆盖治疗[64]。
上述的合成材料覆盖物,其共同的缺陷是只能作为暂时的烧伤覆盖,均需进行二次植皮。
八十年代末,随着组织工程学的建立和发展,以及生物材料研究的不断深入,越来越多的具有活细胞成分的皮肤替代物出现并应用于临床烧伤治疗[2]。组织工程皮肤是应用组织工程原理发展起来的具有生物活力的新一代皮肤替代物。20多年来,组织工程人工皮肤已得到迅猛发展,多种性质的人工皮肤已开始用于临床或正在进行临床试验。
皮肤创伤后的修复过程与多种细胞、基质成分、血管及多肽生长因子等众多因素密切相关,而一些炎性趋化因子、基质分子和某些细胞因子在不同修复阶段调控皮肤内的细胞功能、细胞外基质分泌、皮肤重建等方面发挥重要作用。
(一)细胞外基质(ECM)ECM(extracellular matrix)是指由细胞分泌到细胞外间质中的大分子物质,通常位于上皮或内皮细胞下层、结缔组织细胞周围,构成复杂的网架结构,为组织、器官甚至整个机体的完整性提供力学支持和物理强度。 在简单的多细胞生物系统中,维系各个细胞之间相互关系的ECM,可能仅仅就是基底膜结构。在更为复杂的动物机体中,细胞外基质可有多种存在形式,如皮肤、骨、肌腱、韧带、软骨以及广泛存在的基底膜等。 众多研究表明,ECM除了为组织和机体提供力学支持和物理强度的组织部分,还对其所作用的细胞类型中基因表达的方式,如细胞的粘附、扩散及移行等表现产生影响。 ECM成分主要可分为胶原、蛋白聚糖和糖蛋白三大类。 1. 胶原胶原(collagen)是一类由不同亚基组成的糖蛋白(glycoprotein),是ECM的主要成分。每一种胶原蛋白都由三个不同的亚基组成,或称之为a链多肽。每一条a链自身为左手螺旋构型,三者又相互缠绕在一起形成右手超螺旋结构。胶原蛋白之间的差别就是组成各种胶原蛋白的亚基,或称为a多肽链的一级结构不同。到目前为止,已发现30余种胶原亚基的编码基因。这些亚基以不同的方式组合,形成至少16种不同的胶原蛋白质分子[118]。 在创伤修复过程中,机体可以通过胶原的合成、降解和吸收对创伤愈合和愈合后的组织进行改造,实现组织修复。纤维连接蛋白参与创伤修复过程的始终,它通过与多种细胞和细胞外基质相互作用,加速创伤修复。 胶原由三个相同或不同的前a链组成的均一三聚体(homotriplex)或异三聚体结构。I~XVI型胶原的亚基组成、超分子结构、分子量以及组织分布如表4-1所示。 表4 -1 各型胶原结构与分布特点[118]
I、Ⅱ和Ⅲ型胶原是所谓经典的纤维形成胶原,三种胶原约占体内总胶原的80%~90%。V和Ⅺ型胶原由于与I~Ⅲ型胶原之间有同源性因而也视为纤维胶原。其它非纤维胶原与其它形态的细胞外基质的形成有关。Ⅳ型胶原可形成三维网状结构,Ⅵ型纤维形成球状结构,Ⅶ型胶原形成反平行二聚体、再形成锚定纤维,Ⅷ型胶原则形成六边晶格状结构。 目前皮肤中大约可检测到6种胶原,其中以Ⅰ型、Ⅲ型胶原为主。在创伤愈合早期,Ⅲ型胶原含量常高于正常,随着创伤组织逐渐愈合,Ⅲ型胶原水平逐渐下降而Ⅰ型胶原含量逐渐增高[116]。 胶原产生的量和胶原分子间交联程度决定正常组织和伤口的大小,伤口张力迅速增高发生在创伤修复的第二期肉芽组织增生和表皮移行期。伤口收缩率在伤口张力上升至最高又降到峰值的80%时达到最大。任何改变胶原合成和降解的平衡及胶原分子交联的因素都将影响到伤口张力强度。 2. 蛋白聚糖(proteoglycan, PG)除胶原外,皮肤细胞间质还包括结构性蛋白(层粘连蛋白、纤维连接蛋白),透明质酸、硫酸软骨素等蛋白多糖。这些基质成分作为趋化物质,吸引炎细胞、成纤维细胞(Fb)、血管内皮细胞向损伤区域移动;促进Fb迅速合成和分泌大量胶原,引导上皮细胞覆盖创面;并与胶原分子结合,相互作用,相互影响,共同沉积于基质中。 PG是一系列由一个核心蛋白分子与一个或多个氨基聚糖(glycosaminoglycan ,GAG)侧链相结合的蛋白家族。PG在动物细胞中广泛分布,参与一系列不同的生物学功能。PG分子在细胞外与细胞膜呈结合状态;也可以颗粒状态贮存在细胞内。绝大部分的PG分子与ECM之间有着极为密切的关系,但也有些PG分子与ECM无关。 PG分子的结构相差较大。不同PG分子,除了核心蛋白的结构不同,其GAG分子的类型和大小也往往不同。在不同的发育阶段,细胞表达不同类型的PG分子。氨基聚糖复杂的碳水化合物类型主要包括硫酸软骨素(chondroitin sulfate,CS)、硫酸皮肤素(dermatansulfate)、硫酸乙酰肝素(heparansulfate,HS)、硫酸角质素(keratansulfate)和透明质酸(hyaluronan,HA)。这些分子的共同特点是由2个不同的糖形成的双糖重复序列,其中一个为己糖,另一个为己糖胺。由于双糖键以及硫酸化位置的不同,导致这些氨基聚糖链的结构也不同。 3. 整合素整合素(integrin)是黏附分子的主要家族,介导Fb-ECM的相互作用。整合素是一组细胞表面糖蛋白,是由α和β亚单位经非共价键连接而成的异二聚体糖蛋白,其配体结合区能识别相应配体上的精氨酸-甘氨酸-天冬氨酸序列(Arg-Gig-Asp,RGD)。而ECM成分FN、LN、I型胶原等结构中均含有RGD序列,ECM即通过这些RGD序列与Fb表面整合素的配基结合区特异性结合。α、β亚单位结合后可决定整合素的结合活力和特异性,其功能也受表达细胞的影响。Gailit等[119]研究了介导成人真皮Fb与创面基质蛋白相互作用的整合素。整合素α3β1、α4β1、αvβ3和αvβ1能与纤连蛋白结合;整合素αvβ1、αvβ3则是VN受体。并认为,培养的成人真皮Fb可表达α3β1、α5β1、αvβ1,证实在创伤修复早期的ECM中,可与FN、VN和纤维蛋白结合[120]。αvβ5还能调节细胞表面结合的VN的分化与退化,而αvβ3则无此功能[121]。αvβ5的这种功能有利于ECM的塑型,因为二者接触处是相对的紧密部位,Fb快速向创面迁移需要αvβ5来调节不同的细胞内信号传导途径。 (二)细胞与细胞因子1. 表皮细胞皮肤表皮细胞(EC)属于上皮细胞类型,除具有一般的上皮细胞特征外,可分泌角质,具有很强的角质化特征,以此作为保护上皮,完成表皮的功能。 整个表皮从基底层到表面可分为五层,即基底层、棘层、颗粒层、透明层和角质层,代表了表皮细胞逐步衰老的分化过程。仅有基底层内角质形成细胞(Keratinocyte,Kc)的细胞分裂比较活跃,不断产生新细胞并向浅层推移,以补充衰老、脱落的角质细胞。 角质形成细胞(Kc)既可产生多种细胞因子又是多种细胞因子作用的靶细胞。特别是其分泌的多种细胞因子,在创伤修复中起着十分重要的作用。在炎性因子和损伤因子的刺激下,Kc转化为活性Kc并释放大量细胞因子。这些因子对免疫细胞、血管内皮细胞、Fb等具有明显的趋化活性和刺激生长活性,并刺激间质细胸增殖、分化、促进细胞间质和毛细血管的生成[122]。 2. 成纤维细胞成纤维细胞(fibroblast,Fb)是皮肤真皮层的主要细胞成分,由胚胎时期的间充质细胞(mesenchymal cell)分化而来。Fb可合成和分泌胶原纤维、弹性纤维、网状纤维及有机基质。 组织损伤后愈合过程中的一个重要病理特征是细胞外基质(ECM)合成增加并在伤口周围聚集[123]。有关研究已表明Fb是合成和分泌ECM的主要细胞[124]。 伤口愈合中,部分Fb表达Ⅰ、Ⅲ前胶原mRNA增多[125]。创面愈合过程中存在着高产量胶原的Fb异常亚群,这种高产量胶原亚群的激活机制受多方面因素的调控。 随着分子生物学技术的日益发展,人们逐渐认识到ECM-Fb间的作用在纤维化过程中的意义。ECM不仅构成器官和组织结构的框架,还直接与多种细胞(如Fb、血管内皮细胞、Kc、单核细胞等)的迁移、趋化、增殖和分化有关。 整合素亚族是介导Fb与ECM作用的最主要的粘附分子,细胞粘附分子与ECM结合后的生物学效应主要表现为直接诱导Fb的移行和增殖;或者间接激发其它免疫活性细胞及由此引起的细胞变形与运动,从而产生更多的胶原蛋白、血管生成因子或Fb生长因子,刺激毛细血管生长,加速伤口愈合[126]。 有文献报道ECM与整合素结合后可能发生粘附分子在细胞表面成簇、肌动蛋白合成及表达的变化。 β1整合素由α5、β1两个亚基组成。文献报道,伤口愈合时Fb表面整合素α5、β1亚基较正常皮肤真皮Fb的表达增多,表明Fb表面粘附分子的高表达对组织损伤后伤口愈合有一定的促进作用。Dhawn等[127]的研究表明粘附状态下小鼠NIH3T3 Fb胶原基因表达较细胞悬浮状态时明显增加,提出粘附分子表达可随ECM-细胞间相互作用的变化而自我调控。 (三)成纤维细胞(Fb)与细胞外基质(ECM)的相互作用1. Fb表型与ECM合成和收缩ECM和许多细胞因子可调节Fb表型。Gabbiani等[128]认为,在伤后2周,创面Fb即可发育成具有平滑肌细胞特征的表型,即肌成纤维细胞(myofibroblast,MFb),它与后期ECM收缩有关。伤后3d,创面内纤维素凝块中无Fb浸润,其中仅有FN和VN作为Fb增殖、迁移和合成ECM的暂时性载体[129],此时Fb尚不具备迁移能力,因其动力装置(细胞骨架)对细胞运动有抑制作用,也可能与细胞迁移所需的表面受体不足有关。3d后Fb由静止型向迁移型转换,并向创面中心迁移,同时大量增殖,胶原合成增多。胶原合成表型的Fb的超微结构特征是含有丰富的粗面内质网和高尔基体。伤后10d,用Maddon染色,胶原性ECM变成肉芽组织永久性成分,且纤维蛋白开始浓缩成疏松的束状,Fb表面可出现αv和α5β1二种整合素表达[130]。伤后14d,ECM可发生收缩,与Fb向MFb表型转换有关。Fb通过其伪足的伸出、回缩而收缩其周围的胶原基质,创面中MFb伸出的伪足与Fb或ECM接触即收缩。当细胞-基质复合体置于增高张力状态下,MFb沿张力线拉长。在早期,由于胶原纤维排列的多向性,Fb的胞质沿这些纤维运动并产生多向性突起而呈星状。随着Fb与胶原纤维的相互作用,胶原纤维改构,其排列由多向性转变为单向性。Fb通过α2β1整合素调节ECM收缩,细胞内产生的收缩力量使基质变形,使定植的细胞再迁移。创面愈合后MFb通过细胞凋亡(apoptosis)而死亡、消失,表现为凋亡细胞数量急剧增加[131]。在某些细胞因子或生长因子的异常刺激下,Fb功能活跃,MFb持续存在,导致ECM大量沉积而形成瘢痕增生和挛缩。 2. ECM对Fb功能的影响FN及其片段能促进Fb增殖,使停止生长的Fb重新合成DNA,进入细胞周期[2]。而对LN及其片段的研究表明,LN短臂内部杆状片段含丰富的半胱氨酸,具有“EGF”样重复单位,该结构在其它几种ECM中也存在,在空间结构上有利于蛋白质相互作用。Gauss-Muller等[132]证实FN对Fb、巨噬细胞具有趋化作用,且依赖于FN-Fb间的黏附,通过此黏附作用,细胞膜蛋白和磷酯进行转甲基反应,细胞骨架中微丝微管收缩,使细胞迁移。此后进一步证实,Ⅰ、Ⅱ、Ⅲ型胶原及其降解产物、胶原酶降解片段对Fb均有趋化作用。真皮基质中的蛋白多糖(proteoglycans,PG)可抑制Fb功能[133],其中含量较多的是硫酸软骨素B,包括DS-PGⅠ(biglgean)和DS-PGⅡ(decorin)。Decorin在培养细胞中可抑制转化生长因子β(TGF-β),从而推测Decorin对Fb的抑制作用是通过TGF-β完成的[134]。胶原分泌到细胞外,其裂解产物前胶原肽在转录和翻译水平负反馈抑制Fb合成胶原[135]。创面愈合后,这种负反馈抑制可能减弱乃至消失,使ECM过量沉积而形成增生性瘢痕。 3. Fb-ECM相互作用的调控因子随着Fb和其它细胞迁移至伤口部位,并分裂增殖,伤口处ECM沉积,Fb、内皮细胞和Kc持续合成分泌生长因子,如PDGF、TGF-β、FGF、EGF 等,使细胞持续增殖,ECM合成及新生血管形成。TGF-β对皮肤创伤的正常修复起着重要作用,如在创伤愈合后仍持续发挥作用,很可能形成增生性瘢痕。TGF-β刺激Fb合成ECM,同时抑制胶原酶的产生,并增加胶原酶抑制剂含金属蛋白酶(TIMPⅠ、Ⅱ)和α-巨球蛋白的组织抑制物的产生[136]。烧伤后增生性瘢痕组织中,Ⅰ、Ⅱ型前胶原及TGT-βmRNA较正常皮肤表达明显增加。PDGF是血清中促进Fb 分裂最具潜力的促有丝分裂原,在损伤早期即由血小板释放。PDGF对体外培养的Fb具有趋化和增殖反应,还可刺激Fb合成胶原并使胶原酶活化,调节ECM的更新。同时,促进Fb向MFb表型转换,并获得表达a-平滑肌肌动蛋白的能力,与创伤愈合后ECM收缩和瘢痕挛缩有关[137]。伤后4~5 d,迁移的Fb表达体外黏连蛋白受体,与FGF作用有关,促使Fb向创面趋化。同时,Ⅰ型前胶原颗粒出现在Fb胞浆中,FGF可抑制胶原基质的收缩,其机制与蛋白激酶C激活有关[138]。肿瘤坏死因子(TNF)对Fb增殖具有促进和抑制双重作用,但对ECM合成具有促进作用。γ-干扰素(γ-INF)则可抑制Fb增殖和ECM合成[139]。 近年来,作为生物体内重要的信息分子和效应分子的一氧化氮(NO)在创伤修复中的作用日益受到重视[140]。局部组织中,NO是活体细胞在一氧化氮合酶(NOS)的催化下,以L -精氨酸为底物,在有氧条件下生成的小分子物质。在正常皮肤Kc、血管内皮细胞和真皮Fb均可观察到NOS活性[141-142]。Schaffer等[143]认为,NO可促进创面胶原沉积,并加强创面愈合的机械张力。在创伤早期,NO具有舒张血管作用,并促进血管再生,有利于创伤的正常修复。在修复晚期,因ECM过度沉积而形成的增生性瘢痕和瘢痕疙瘩中,NOS表达却下降[144-145]。局部组织中,NO合成量减少,从而引起瘢痕组织中Fb异常增殖,ECM过量沉积。病理性瘢痕组织中NOS表达及NO合成减少的机制及意义尚未完全明了,可能与TGF-β抑制NO释放或组织中缺乏酶底物(L-精氨酶)致NO合成量下降有关。可以推测局部组织细胞合成分泌的NO,可能抑制Fb过渡增殖,NO替代疗法,也许可为防治增生性瘢痕提供一条新的途径。 |
(一)人工表皮
1. 自体角质形成细胞(Kc)膜片
自体皮移植物虽然理想,但对于大面积烧伤患者的治疗,往往受皮源限制。许多研究者开始寻找体外培养角质形成细胞的方法[65,66]。
1975年Rheinwald和Green[66,67]首先提出了上皮细胞的培养技术,解决了上皮细胞体外的传代扩增的难题,使体外培养人工皮片成为可能。从患者取得小块皮肤,体外培养上皮细胞,经2~3周培养,即形成复层上皮,再回植患者,解决了皮肤缺损的修复。
1984年Gallico[68]等报道了培养的自体Kc膜片在大面积深度烧伤中的成功临床应用,标志着开创了烧伤治疗的一个新时代。这种培养的自体角质形成细胞膜片开始应用于临床全厚烧伤创口的覆盖[69]。优点有:能用自体细胞提供大面积的永久性创面覆盖,成功重建表皮,阻止水分丢失和微生物污染。目前,移植培养的自体Kc技术在美国、澳大利亚、欧洲等国家和地区已常规应用于烧伤治疗中。在肉芽创面上直接移植培养的自体Kc膜片的接受率(take rate)平均为60%左右[70]。
然而,过去20年的临床应用表明,自体人工表皮存在明显缺陷:必须取患者的皮肤活检标本和2~3周的准备时间;培养后收缩明显,且薄而脆,不宜临床操作;移植后耐磨性差、易起疱,尤其不适于全厚真皮损伤的创面;移植成功率主要与创面细菌污染程度有关;费用昂贵;获得的临床效果差于自体皮片移植[71-75]。
为解决单纯人工表皮的缺陷,人们意识到需在皮片下方增加支持物,以满足临床上一定厚度、韧性和可操作性的要求。Horch[76,77]报告以纤维蛋白为载体,培养上皮细胞,植入裸鼠皮肤缺损,伤口愈合良好。Medalie[78]和Butler[79]则分别以无细胞的尸体真皮和人工合成的胶原海绵为载体,也较好地解决了单纯皮片所遇到的问题。为减少人工表皮的体外培养时间,Horch[80]将上皮细胞接种在胶原膜上,几天后细胞融合成单层即进行移植。与常规作法相反,表皮层向下贴附于创面,表面为胶原膜,移植后表皮细胞可在移植区继续增殖,缩短了创面愈合周期。
2. 异体Kc膜片
培养的异体Kc因其可及时应用和来源不受限制等优点,已成功用于临床[81]。许多研究表明培养的异体Kc膜可作为暂时性创面覆盖物,刺激创面愈合,直至被自体Kc所替代。由于异体Kc存在免疫排斥反应,不适于大面积深层创面的治疗[67]。
(二)人工真皮
机体对真皮缺损的应激性反应是,首先在胶原暴露部位血小板聚集,脱颗粒,并介导一系列炎症反应。创面若未及时清创和关闭,则发生炎性浸润,肉芽组织增生,成纤维细胞迁移,胶原过量表达,肌成纤维细胞介导的收缩等[82]。这一过程的主要作用是防止细菌侵入和关闭缺损,而不是缺损组织再生,可使全厚创面缩小10%。其代价是,轻则创面挛缩和形成较大的疤痕,重则留下慢性开放性创口。两者均可给患者造成长期的病痛和永久性的功能障碍。
因此,研究开发永久性的真皮替代物是解决这一临床问题的关键。设计真皮替代物,需考虑以下几个临床特点:1)游离厚皮移植物的真皮层越厚,移植收缩越小;2)全层皮移植物的收缩极小;3)全厚真皮损伤是通过收缩和疤痕产生次表皮疤痕组织进行修复,与原正常真皮不同;4)浅层真皮缺损的创口,形成的疤痕较小;5)烧伤创面的开放时间决定了烧伤患者病程的长短。据此推测,是真皮传递信息给创口,以调整愈合过程。因此,真皮替代物需同时具备:1)控制炎症和收缩;2)引导自体真皮再生。
目前的几种永久性人工真皮,是从不同的方式设计制作。
①Integra是由Burke 和Yannas设计开发的一类无细胞人工真皮[44](见前述)。
②Bell等[83,84]将成纤维细胞混入胶原凝胶,于体外进行组织培养,形成具有生物活力的人工真皮。成纤维细胞在胶原凝胶内扩增并重新组织胶原形成一收缩的真皮基质,同时分泌自身的胶原和其它基质。胶原蛋白的浓度和细胞密度决定了收缩程度和最终的面积。动物实验表明,这种人工真皮可用于全厚皮损伤的移植修复,并可支持表皮细胞的生长形成表皮层。
③Dermagraft是ATS开发的另一类组织工程化的真皮替代品[85,86]。与Integra相比,Dermagraft在人工真皮网架内增加了活细胞成分,将增殖能力强的新生儿包皮成纤维细胞和胶原种植于生物可降解材料上,Fb可在网孔内增殖,分泌胶原、氨基多糖等基质成分和生长因子等[87,88]。免疫组化证明[89-91]:其间充满I、III、IV型胶原,弹性蛋白、纤维粘连蛋白(FN),脱氧胆酸及核心蛋白多糖、巢蛋白等,其中FN含量较高,与胎儿皮肤相近。FN有促进细胞游走和基底膜形成的作用[92-95]。Westernblot检测有碱性成纤维细胞生长因子(bFGF)存在,聚合酶链反应(PCR)确认有胰岛素样生长因子1,2及血小板源性生长因子(PDGF)的mRNA存在。这些因子同创面分泌的一些细胞因子相互作用,刺激血管的新生及成纤维细胞的长入[96-97]。其中,Drmagraf-TC内层由三维尼龙丝构成支架材料,表面亦采用硅胶膜,移植后可在移植部位保持6周,而异体皮仅能保持2~3周。Dermagraft-TM则使用可降解的聚羟基乙酸作为真皮支架,移植后支架成分逐渐被降解,种植的Fb则产生新的真皮基质。临床证明,Dermagraft可有效用于糖尿病溃疡的治疗[71]。
(三)人工复合皮肤
理想的皮肤替代物应具有表皮和真皮结构,即位于表层的表皮细胞和位于真皮层的成纤维细胞,能够同时修复所缺失的真皮和表皮层。因为这两种成分不仅影响皮肤的功能和外形,而且具有相互影响的机制,促进彼此的分化。
①Apligraf是在Bell等[83,84]研究基础上开发的一种包含上皮细胞和成纤维细胞的双层组织工程皮肤,是目前较成熟的人工皮肤。其成纤维细胞和角质形成细胞来源于患者自身皮肤,具有更好的组织相容性。真皮层是由Fb、牛I型胶原、血清等形成凝胶,表面接种上皮细胞,体外培养7~10天形成含上皮角化层的人工复层皮肤。将其用于治疗老年人静脉性溃疡,溃疡愈合快,临床亦未见对异体细胞所构建人工皮肤的排斥反应。但由于该方法,从患者身上取细胞到形成产品需要数周,为及时关闭烧伤创面,需要先由其它皮肤替代物暂时覆盖[98-100]。
②另一种Apligraf,其细胞成分均来源于新生儿包皮,经体外培养所得,移植后受体接受率达100%。移植后28天,收缩率为39%,表皮细胞分化良好,移植后14天可见连续的基底膜形成[101]。该代用品1997年在加拿大已获准进入市场,正在向FDA申请进入美国市场[102]。
当然,以Bell方法构建的人工皮肤及其同类产品在烧伤治疗中仍然存在缺陷[103],目前尚未被FDA批准应用于临床。
③Boyce等[104]则在组织工程复层皮肤的应用上作了进一步探索。首先,对大面积烧伤患者及时进行创面清除术并以Integra覆盖创面;同时,从患者身上取得成纤维细胞和角质形成细胞,在类似Integra的胶原海绵上接种自体成纤维细胞,体外培养一定时间直至成熟形成真皮层,然后将体外扩增的角质形成细胞接种于真皮层表面。经过一定时间培养和将表皮层暴露于气液界面,最终形成一种双层的自体组织工程皮肤替代品,并移植于Integra的新生真皮之上。经过6个月观察,未见疤痕形成。该方法虽然昂贵,但通过Integra技术与组织工程技术的结合,充分展示了未来组织工程皮肤的应用前景。
近年来国内组织工程皮肤研究进展较快。曹谊林等[105]将体外培养的猪自体表皮细胞与成纤维细胞,分别与30%氧化异丙烯F-127混匀成细胞悬液后,种植聚羟基乙酸(PGA)形成细胞-生物材料双层皮肤替代物,直接用于修复全层皮肤缺损。结果,第1周新生组织即出现表皮与真皮双层结构,特殊染色观察到连续的基底膜。修复后第8 周组织工程化皮肤的形态结构均与正常皮肤相似。鲁元刚等[106]则将成纤维细胞混入鼠尾胶原、壳多糖、硫酸软骨素、透明质酸、弹性蛋白等复合凝胶材料内,再于表面接种表皮细胞,形成复合壳多糖人工皮肤。
吉林大学再生医学研究所自1992年开始开展组织工程人工皮肤的研究,先后成功构建了大鼠人工真皮、大鼠复合人工皮肤(1995)[107-109]、人类人工表皮、人类人工真皮和人类复合人工皮肤(1998)[110]。该复合人工皮肤是以胶原网架为载体,先后接种成纤维细胞和表皮细胞,经过3-4周体外培养,形成的复层皮肤具有与人类正常皮肤相类似的形态结构特点和新陈代谢过程。随后,应用壳多糖网架构建成功的复合人工皮肤组织,移植于裸鼠,取得较好的修复效果[111-112]。
(四)存在的问题及展望
虽然组织工程皮肤的研究已取得可喜的进步,并开始应用于临床,但仍然存在一些问题:1)组织工程皮肤移植虽不引发临床常见的排斥反应,但一般认为它将最终为受体自己的组织所取代;2)目前的体外培养过程周期仍较长,难以及时满足临床需要[113];3)移植中发现由于组织工程皮肤没有血管系统供给营养,表面的上皮容易坏死脱落;4)目前组织工程皮肤的韧性及机械性能同天然皮肤仍有较大的差距[114]。
理想的人工皮肤应具备以下特点:1)经济、易获得、体外可保持较长时间;2)耐用且可随时得到,具有柔韧性和一定的机械强度;3)有防细菌侵入及体液丢失的屏障功能;4)移植后能随创面生长,但不会过度增生形成疤痕;5)安全、不携带病毒[113]。
随着材料科学和组织工程技术的进步与合作,可望研制出一种功能与自体皮肤相同、具有表皮和真皮结构的皮肤替代产品[44]。
广义上说,凡是与骨损伤和修复相关的所有金属、陶瓷、高分子及复合材料均属于骨再生医学材料,以发挥固定、支撑、填充、替代或引导和诱导骨生成的功能。
而准确意义上的骨再生材料,应该是指通过直接或携带细胞和生长因子等填充骨缺损、从而达到引导或诱导骨生长作用、实现骨缺损修复的那些特殊类型生物医学材料。
理想的骨再生材料通常需要具备:1)生物降解性,能够发挥边降解吸收和边引导骨生成作用,直到完全降解而不在体内残留;2)生物矿化能力,含有矿化物质或能够促进矿物质沉积,诱导成骨细胞分化和有利于骨生成;3)一定的机械强度,发挥支撑和力学传导功能,满足天然骨骼应力生长的自然特性;4)生物活性,含有生长因子或干细胞等生命物质,能够更好地诱导骨骼生成,实现长距离或大面积骨缺损的修复等等。
骨再生材料可以是条块状、颗粒状或纤维状的固态材料,也可以原本是液态的可注射的水凝胶材料,或者是粘合剂材料。后者更是现代医学骨外科近年来快速发展的微创或无创乃至介入技术临床急需的一类重要新材料。
可以预测,随着对骨损伤与修复机制的不断深入研究,将赋与未来骨再生材料更多的内涵(如新的成分、结构、性能和功能)。而化学、材料与工程、生物学和医学等多领域多学科的交叉和快速发展,将使我们能够创造出类似于天然骨骼甚至比天然骨更强的骨再生生物材料。
【研究进展】
1.1天然衍生高分子
脱钙骨基质(demineralized bone matrix,DBM)是骨修复材料中最重要的一种天然衍生材料,经盐酸处理获得,具有骨传导性和骨诱导性[95-97],目前已用于临床。早在20世纪60年代初,Urist等在动物实验中采用脱钙骨在异位组织诱导骨形成获得成功[97-99]。最近的研究表明皮质骨由于有较好的骨传导性和较低的免疫原性比松质骨更适合于制备DBM [100]。Urist还阐述了在DBM作用下异位组织新生骨形成的组织学过程[94,95]:开始时炎细胞浸润和间质细胞长入,之后3周出现早期的血管生成,骨原细胞和软骨细胞增多。紧接着数周,成骨细胞、骨细胞和软骨细胞引导软骨生成并转化为不规则骨;植后第4周,成骨细胞和骨重塑细胞(bone remodeling cells)出现,4~6周时骨髓形成。这一过程即为软骨内骨化过程。
Russell和Block指出,DBM的处理方式直接影响其最后的骨诱导活性[101,102]。以环氧乙烷作为消毒剂,可使DBM完全丧失骨诱导活性,而不影响骨传导性。另外,他们认为乙醇可以有效减少基质的细菌污染机会而不影响DBM骨诱导活性。DBM已被用于临床整形外科治疗骨缺损、骨不连(Bone nonunion)和关节融合等[101]。
1.2 合成高分子
合成可注射高分子用于骨组织工程支架,由于其可微创移植而备受关注。Elisseeff等合成了一种可注射的光聚合材料[103],这种材料除了可用于透皮治疗系统,在整形外科方面也具有潜在的应用前景。
Gogolewski研究小组采用PLLA多孔膜(孔径5-15um,厚250um,体内降解时间为18-24个月)覆盖成年兔长1cm的骨缺损,结果整个缺损处皮质骨再生[104]。该研究组在另一项研究中,以Yucatan猪为模型,建立了1/4长的桡骨缺损,缺损处以PLLA、PLDL(poly-L-co-D,L-lactide)膜或以碳酸钙复合的PLLA、PLDL膜覆盖。结果显示,聚合物膜加速了新骨生成而无明显副反应[105]。但聚合物膜的这种能力是有限的,对于更长的缺损则无法实现愈合;当聚合物膜与松质骨联合使用时才能诱导显著的骨愈合。研究者认为,聚合物膜除了上述作用外,还可优化骨移植物与软组织的联系以及防止移植物发生过度的吸收[106]。
另一种可用于骨的填充物是己内酯-丙交酯共聚物(poly-e-caprolactone –co-lactide)。这一聚合物曾用于治疗骨不连[107,108],最近又以骨膏或骨蜡形式被用于骨组织工程。Ekholm 等应用大鼠股骨缺损模型评价了该聚合物的吸收性和生物相容性[109],结果只引起适度的炎性反应,植后1年仍有聚合物存在。
光交联活性的聚酸酐(polyanhydrides,PAH)是一类在整形外科具有独特用途的新材料[110]。该聚合物通过表面侵蚀吸收,因此不会突然崩解,在药物传递时也不会出现爆释现象。而独特的光聚合物作用不仅使其具有多孔支架微细加工的潜在应用性,还可作为可注射的组织工程支架。研究表明,这些聚合物经光照射后力学性能明显增强[110]。
1.3 高分子复合物
高分子与陶瓷的复合物也被用于骨填充物。Peter等将PLGA与羟基磷灰石复合,采用粒子法制备多孔支架,以增强其耐压性能[111]。Mikos报导了一种聚丙烯延胡索酸酯(polypropylene fumarate,PPF)作为生物可降解骨水泥,与可浸出的组分混合,注射入骨缺损[112,113]。材料本身的聚合可导致CO2的释放,形成多孔支架[114]。可注射的特性使其可用于填充不规则的骨缺损,而可浸出的组份可为骨生长提供空间。该材料还可潜在地应用于药物释放系统,通过与磷酸三钙复合可增强其力学性能[115]。
同样,Bennett将一种poly-dioxanone-co-glycolide与HA or TCP的复合物作为可注射的或可模压的灰泥[116]。注射后发生的交联反应使材料释放出CO2,并形成互相连接的孔隙。CO2还可引起材料的膨胀,尤其重要的是形成了一个嵌压适应(press-fit)的无缝界面。
Zhang 和Ma通过将多孔PLLA材料浸入人工体液内,使整个支架内形成磷灰石,制备了PLLA/磷灰石(apatite)复合物[117]。通过水解和晶核形成来增强磷灰石的生成,其大小和数量与暴露的表面积相关。这种方法既可用于制备骨组织工程支架,也可用于评价组织工程支架的成骨性能。他们还采用标准的加工技术,即热诱导的相分离(TIPS )制备了PLLA/HA 多孔支架[118]。通过调节组分浓度、温度和降温速率可更容易控制聚合物的微孔结构[119]。
1.4 无机陶瓷材料
可吸收的无机材料包括CaCO3(argonite),CaSO4~2H2O(熟石膏),and Ca3(PO4)2(b-白磷钙石,TCP的一种)等。研究最多的磷酸钙陶瓷为TCP,HA (Ca10(PO4)6(OH)2)和最近发展起来的磷酸四钙(tetracalcium phosphate)[120,121]。
磷酸钙类化合物在骨修复中应用,很大程度上取决于它们的生物相容性。由于不含蛋白,它们所引起的免疫反应、异体排斥或全身毒性均很小。无机陶瓷具有明显骨传导性,与骨直接结合的能力很强,但无骨诱导活性[120,122]。
Friedman等制备了一种新的磷酸四钙BoneSourceTM。这是一种粉状的羟基磷灰石,与水混合后,变为均匀的粘糊状,凝固后可生成孔径为8-12um的微孔结构。与以往的HA移植物不同是,BoneSourceTM 移植后可迅速与骨粘合,并且直接转化为新生骨而移植物的体积不会缩小。这一过程被定义为骨转化(osteoconversion)。将BoneSourceTM应用于临床103例颅骨缺损治疗,手术成功率达97%[121]。
Interpore 200是INTERNATIONAL公司于70年代开发的一种含羟基磷灰石珊瑚人工骨,具有与人类骨组织相似的结构和成份,平均孔径200mm。由于羟基磷灰石降解缓慢,因而可预先加工成适当的形状和预制血管化骨片[123]。
随着光聚合生物高分子的发展,陶瓷的加工也有新的进展。Garg等结合立体激光快速样板制造技术(stereolithography technology),将生物陶瓷混入光敏感高分子水溶液内配成浓缩混合体制备陶瓷构件,其孔尺寸和孔隙率精确可控[124]。
2.1 骨形态发生蛋白(BMPs)
1967年,Urist 等在首先制备出DBM的同时,提出DBM的骨诱导性来源于一种新的诱导因子[125]。几年后,Urist 和Strates将这种因子命名为骨形态发生蛋白(bone morphogenetic protein,BMP),并且从大鼠和兔中提纯出BMP[96,126,127]。此后,研究发现BMPs实际上是负责胚胎发育过程一系列事件和出生后骨化的一组蛋白质[93,128]。
由于BMPs在许多方面的重要作用,如胚胎的骨骼形成,骨诱导作用和骨修复作用以及可作为自体骨移植物的替代物[129,130],因而在整形外科中具有重要的应用价值。到目前为止,已有15种BMPs被鉴定和克隆[93]。Wang和Sampath分别重组了人骨形态发生蛋白2 和7(rhBMP-2,rhBMP-7),并且发现在大鼠模型中均具有在异位组织诱导骨形成的能力,这一过程类似软骨内骨化[129,131]。Einhorn研究表明,经皮注射rhBMP-2可加速大鼠正常的骨折愈合过程[132,133]。
Bostrom等应用BMP-2抗体研究了骨折愈合组织中BMP-2的表达,发现骨折愈合经历了两个深染的阶段,第一阶段为初始阶段,在原始间质细胞和软骨细胞内;第二阶段是在成骨细胞内,发生于成骨细胞进入软骨样基质时[134]。说明BMP-2在骨折愈合过程中的不同阶段均发挥其重要的调控作用。
尽管BMPs的应用对整形外科非常重要,但在实际应用中,尤其是直接应用,往往不能发挥正常作用。因此,需要借助一定的载体,使BMPs在体内缓慢释放,以保持较长时间的活性。
2.2 以材料为载体的释放系统
在不同的实验模型中,BMP已被用于局部释放以修复骨缺损和骨不连[135-149]。释放系统包括DBM、胶原复合物、纤维蛋白、磷酸钙、PLA、PLGA、PLA-PEG、羟基磷灰石、牙科石膏和钛合金[93,150-154]。理想的释放系统应该具备:1)能使BMPs缓慢释放,缓慢发挥生物学作用,可快速吸收,以及支持细胞增殖和血管再生;2)具有足够的刚性直至被完全吸收;3)易于保存,操作和消毒[93,155]。
2.2.1 天然衍生高分子释放系统
对于长骨如胫骨的大部骨缺损,目前的治疗方法通常局限于多级重建或截肢[156]。研究者们将BMP 2 和7应用于治疗长达17cm的临床和实验骨缺损,结果表明,可显著有效地提高骨缺损的愈合能力[93, 132, 140, 149, 158-161]。Yasko 等[149]对45例大鼠的股骨造成5-mm缺损,以DBM为载体与重组人骨形态蛋白rhBMP-2结合应用于缺损处,结果证明BMPs可作为骨移植替代物而来源不受限制。
Reddi 和Levine均以不溶的胶原作为BMP载体,并指出胶原基质的局限性[143,162],可能的原因是胶原的压缩强度低。但通过将胶原基质与HA、TCP、玻璃珠和聚甲基丙烯酸甲酯(polymethylmethacrylate)进行比较后认为,胶原更适合作为药物释放基质[162]。
Johnson等[161]收集了25例患有顽固骨不连并有部分或完全骨缺损病例,其中23例经过三次外科手术均未实现骨末端融合。这些患者经过3-7个月的hBMP和DBM作为贴敷或镶嵌移植治疗,结果20例实现了骨连接,剩下的5例经过第二阶段治疗其中4例获得骨连接。
但研究者认为,天然衍生材料作为BMP载体,往往由于亲水的BMP释放过快,在骨诱导发生之前即已完全扩散[163-165]。同时,天然衍生材料还存在抗原性以及携带病毒及其它病原微生物的风险[81,93,.128,141,100,158,159,161]。
2.2.2 合成高分子释放系统
尽管合成高分子如PLLA具有炎性反应和吸收时间较长等缺陷,但由于其独特的理化特性,可作为BMPs的一种靶向释放载体[163]。早在1987年,Ferguson等将纯化的牛BMP 混入PLGA修复骨缺损,结果16周时新生骨在未吸收的聚合物周围形成,而直接应用BMP的动物则完全修复。因此,作者认为聚合物造成的屏障可阻碍骨的完全形成;只有降解较快的共聚物适合于BMP的控制释放而不影响骨的形成[137]。Kirker-Head等将rhBMP 2 与PDLGA(poly-D,L-lactide-co-glycolide)粒子(150-500mm)和自体血液混合,用于治疗10只羊2.5cm长的股骨缺损,结果其中5只获得治愈。缺损处共聚物被完全吸收,松质骨和皮质骨桥接于整个缺损[166]。Miyamoto[163]评价了数例以PLAs 和不同分子量的聚交酯(polylactides)作为BMP载体的动物实验,聚合物分别采用缩聚和开环聚合的方式合成。结果表明,不同的聚合方式得到了不同分子量的聚合物,PLA/BMP或PLLA/BMP复合物的形貌也发生明显改变,变化范围从粘性液体直到微球;而且完全降解所需要的时间也随之改变。实验所用的BMP是从大鼠骨肉瘤(osteosarcomas)中提纯出来。所有的聚合物中,只有分子量为650 daltons 的PLA可有效地透导异位骨再生(大鼠腹部肌肉),并且2周时完全降解。随后的研究中,他们将650-dalton PLA/BMP复合物与200-dalton PEG复合,在大鼠腹肌中移植后成功地诱导了骨生成和骨髓生成。将羟基磷灰石混入这种复合物,可使其从粘性液体转变为膏状物;根据性状不同,粘性复合物可用于可注射的骨诱导材料,而膏状复合物可作为基质支架[154]。
除了分子量,支架的结构和形状也可影响BMP的释放,根据不同的用途需制备不同结构的释放系统[162]。
2.2.3 陶瓷释放系统
Koempel等提出将BMP复合入孔径为200-500的多孔HA可以增强宿主骨内生长[142]。Tsuruga 等[153]系统地研究了BMP在不同孔径HAs内的释放,发现孔径为300-400的HA,骨形成能力最强。Takahashi 等应用合成的多孔HA与高剂量的rhBMP-2复合,对14只山羊行多节段颈椎前路固定术,尽管缺乏术后固定作用和多孔HA存在的自身缺陷(脆性、降解缓慢、无骨诱导性和力学性能下降),但全部动物出现了骨融合[148]。Asahina 等将HA/胶原/牛BMP复合物置入灵长类动物模型的人工腭骨缺损,结果骨诱导作用明显好于对照组[135]。Gao等将山羊BMP/胶原复合物与孔径为200-400mm的HA管状支架复合修复山羊胫骨缺损,显示了较好的骨传导性和骨诱导性,新生骨的硬性组织形成和力学性能提高均高于对照组[138]。
3.1天然衍生高分子
胶原已经被广泛用于细胞支架。由于胶原本身没有结构性的力学性能,需要对其进行改性,以便在骨再生愈合过程中支持骨的力学传导。Yaylaoglu等将多孔胶原浸入含钙溶液,使磷酸钙沉积于支架内,改善了胶原支架的力学性能,经软骨细胞培养表明,具有较好的骨科应用前景[167]。Du等研究表明,胶原膜可作为骨组织复合支架的基本材料[168]。实验中,他们先将HA沉积于商业用胶原膜的表面,然后将骨碎片置于HA上面,向内巻成管状支架。结果,该材料孔径从几十到几百微米不等;具有可吸收性和弹性;细胞可从骨碎片向基质内迁移,因而是一种具有生物活性的材料[168]。
3.2 合成高分子
聚丙交酯(PGA)纤维无纺支架由于具有快速吸收的优点,是一种常用的组织工程支架[169],但由于力学性能差,不适合于骨组织工程[170]。通过与力学性能好的另一种材料结合,可形成稳定的支架。如将其浸入PLA溶液进行固化[171],还可制备PLA包被的PGA管作为骨科的特殊材料。Puelacher 等[169]研究表明,将骨原细胞接种于经固化的PGA管状网架内,可用于大鼠股骨缺损模型的长骨缺损替代物。
Vacanti[172]将牛骨细胞接种于PGA无纺网内形成细胞-支架复合物,植入裸鼠皮下形成了新的骨组织。早期标本中可见到软骨组织,以后逐渐形成成熟的骨组织。10周后标本具有骨的形态,其中有明显血管增殖、区域性的软骨膜内骨化、小的软骨岛及骨髓细胞成分。
目前,许多研究者正在尝试构建组织工程人工关节。关节是由几个不同类型的组织构成,包括软骨组织和骨组织等。构建如此复杂的组织,需要适合不同细胞生长的聚合物。Isoga等将软骨细胞、腱细胞(tenocyte)、骨膜成骨细胞(periosteal osteoblasts)分别接种于几个不同的PLA固化的PGA网架内,然后以可吸收缝线缝合在一起,进行共同培养,并移植于裸鼠皮下,试图构建指关节[173]。但目前尚无法实现这一复杂技术,而这一基本概念可用于骨软骨缺损的修复。
一些新型合成高分子作为细胞支架引起人们的极大兴趣。Attawia等将聚酸酐亚胺共聚物(poly-anhydride-co-imides)作为骨组织工程支架,特点是通过表面侵蚀而吸收,体积损失更可预知;而且具有较高的力学强度和硬度,压缩模量可达10-60MPa[174]。
3.3 陶瓷材料
Solchaga等将两种商品化的HA支架与一种磷酸钙陶瓷多孔支架[175]进行比较:商品化的HA支架,一种是Hyaff 11(Fidia Advanced Biopolymers; Abano Terme,意大利),孔径为100-400mm,孔隙率为80%;另一种是ACP (Fidia Advanced Biopolymers;Abano Terme,意大利),孔径为10-300mm,孔隙率为85%。多孔磷酸钙陶瓷支架含60% HA,40% TCP,孔径为200-400mm,孔隙率为60%。将这些材料接种骨髓祖细胞,然后移植于大鼠皮下。ACP支架和TCP陶瓷的细胞粘附数相同,但均显著低于Hyaff 11。ACP由于没有细胞层保护,吸收较快,于皮下3周即降解消失。Hyaff 11由于孔较大且开孔较多,细胞在整个支架内分布较好。ACP 支架浸水后体积可增大三倍,导致孔内细胞可用空间缩小。这就说明,高孔隙率和合适的孔尺寸对细胞在支架内分布极为重要[175]。
3.4 复合材料
Laurencin等[176]研究了一种PLGA/HA作为可降解生物支架,运用于成骨细胞和体外分化增殖试验,细胞与载体的结合性能好,并能在三维多孔隙的支架材料上维持细胞表型、分层生长,其碱性磷酸酶活性持续增强,并在第21天能形成具有矿化特征的物质,表明这种合成材料可作为骨组织再生的支架载体。
虽然,许多研究都表明带有活细胞成分的组织工程骨在促进骨骼愈合和愈合质量、诱导骨再生等方面均具有不可替代的作用。自体细胞构建的组织工程骨由于来源不受限制,可望替代自体骨,成为最理想的骨移植物。但是,组织工程骨真正进入临床,尤其是形成商品化,还需要细胞生物学、材料科学和工程学等多学科的进一步研究和支持。
骨组织工程面临的问题主要有:
1)细胞的来源与分化,尤其是具有成骨能力的细胞与材料之间的相互作用关系。
2)生物材料的发展。生物材料的开发和支架的设计对骨细胞的合理刺激和分化极为重要。人工组织能否长期存活依赖于支架内的微环境。
3)体外培养体系。生物反应器为成骨细胞的体外快速大量扩增提供可能。生物反应器还可用于研究细胞的浓度与材料类型之间的关系,以及培养时间对骨骼形成的影响。
4)BMPs等生长因子的应用。如何保持生长因子的活性和长期有效性,还需要进一步方法学支持。
另外,临床实际应用中,还需要考虑其成本和手术对患者的创伤。理想的方式是开始时容易操作和成型,移植后迅速固化。温度敏感水凝胶和光聚合高分子在这一方面具有潜在的应用性。
总之,随着组织工程技术和再生医学的进一步发展,细胞生物学、材料科学和工程学等多学科的通力合作,将为骨修复重建外科带来一场革命性的变化。
神经元和神经胶质细胞在中枢神经损伤修复中明显作用,在这次学习中,我们主要在解剖和组织胚胎学方面对神经元和神经胶质细胞结构和功能略作讲解:
神经元:
胞体:单核细胞,细胞养分合成的主要部位。主要功能:可兴奋细胞,神经电信号的发送者。树突:大量分支的短丝结构,接收外界传入的信号。
轴突:单一长丝状纤维物质,传递信号到远处细胞,外层包裹髓鞘,电信号在髓鞘间郎飞节跳跃式传导
神经元按形态学分类:1;多极神经元:运动及中间神经元
2;双极神经元:感觉神经(听觉、味觉,视网膜)
3;单极神经元:感觉传入神经元
神经元按功能学分类:1;感觉神经元
2;运动神经元
3;中间神经元
神经胶质细胞:
分类:星形胶质细胞:胶质瘢痕主要成分
少突胶质细胞:中枢神经髓鞘主要成分
小胶质细胞:损伤后脊髓神经免疫作用
雪旺细胞:外周神经髓鞘主要成分
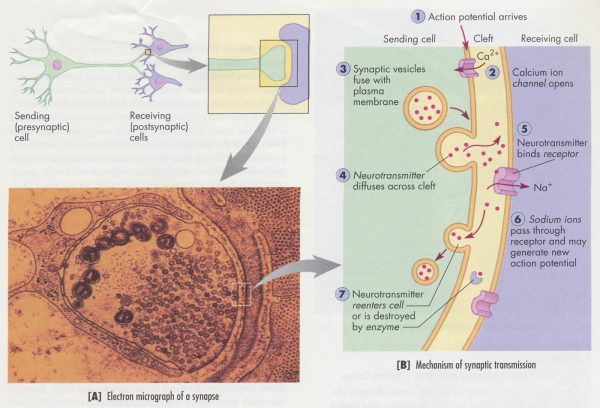
突触:轴突末端和远处树突信号传递的物质
结构:突触前膜、突触后膜、间隙
(张逸)

神经元和神经胶质细胞在中枢神经损伤修复中明显作用,在这次学习中,我们主要在解剖和组织胚胎学方面对神经元和神经胶质细胞结构和功能略作讲解:
神经元:
胞体:单核细胞,细胞养分合成的主要部位。主要功能:可兴奋细胞,神经电信号的发送者。树突:大量分支的短丝结构,接收外界传入的信号。
轴突:单一长丝状纤维物质,传递信号到远处细胞,外层包裹髓鞘,电信号在髓鞘间郎飞节跳跃式传导
神经元按形态学分类:1;多极神经元:运动及中间神经元
2;双极神经元:感觉神经(听觉、味觉,视网膜)
3;单极神经元:感觉传入神经元
神经元按功能学分类:1;感觉神经元
2;运动神经元
3;中间神经元
神经胶质细胞:
分类:星形胶质细胞:胶质瘢痕主要成分
少突胶质细胞:中枢神经髓鞘主要成分
小胶质细胞:损伤后脊髓神经免疫作用
雪旺细胞:外周神经髓鞘主要成分
突触:轴突末端和远处树突信号传递的物质
结构:突触前膜、突触后膜、间隙
(张逸)
近年来,干细胞生物学研究取得巨大进展,为人类再生医学带来了希望。通过对干细胞特性的基础性研究,结合组织工程多学科方法,以成功地提供合适数量和类型的细胞,最终实现新的功能组织的形成。胚胎干细胞(Embryonic stem cell,ES cell)是多潜能性细胞,它在体外既可无限增殖,保持细胞表型,又能参与胚胎发育,进而分化为各种类型的细胞和组织,直至形成器官。目前,胚胎和成人组织器官中的干细胞和多潜能祖细胞(multipotentprogenitor cells)分离鉴定在研究和临床上均取得重大突破。通过体外或体内操作,将干细胞分化成多种不同类型细胞指日可待。这一技术将克服传统的器官移植所带来的诸多问题。
- 种子细胞来源与培养体系
- 表皮干细胞(ESC)与角质形成细胞(KC)
- 毛囊干细胞(HFSCs)
- 骨髓间充质干细胞(MSCs)
- 脂肪干细胞(ADSCs)
- 微载体生物反应器3D培养技术
1. 细胞来源
细胞、支架和生长因子是构建工程组织的三个关键因素。其中一个主要问题是既能在临床上存活又能适用于组织工程的细胞类型的鉴定和分离[20]。以往,人们认为除皮肤,小肠粘膜和血液外,成年组织中并不存在与组织再生相关的“关键”细胞(如前体细胞或干细胞)。然而,目前已经于多种组织中发现了所谓的“关键细胞”。如造血干细胞、间充质干细胞(MSCs)等。研究显示,MSCs具有定向分化的潜能,可分化成骨、软骨、脂肪和心肌细胞[21]。分离的人类MSCs现已投入商业应用[22],MSC系统可望实现医疗产业化。
组织工程所用的细胞可来源于病人自体细胞,同种异体细胞和异种细胞。
尽管应用异种细胞可能存在感染动物病原体的潜在危险性,但在获得人类供者器官或组织完成自身修复之前,异种细胞可为患病组织提供暂时的支持。
同种异体细胞已被成功地用于治疗皮肤溃疡,糖尿病和肝脏疾病[23-25]。在美国,FDA批准的两个实验室构建的活皮肤产品已经用于治疗糖尿病或者静脉性皮肤溃疡。其中一个产品由人类新生儿真皮成纤维细胞组成。新生儿成纤维细胞经体外扩增,种植于由聚合物polymer polylactide coglycolide制作的薄支架上,这种聚合物可在水中逐渐降解[26]。
若临床上应用患者自体已分化的MSCs,将不再存在免疫排斥问题。最近,已从胚胎和成年体内分离到各种干细胞,并在细胞分化上显示其灵活性和可控性[27]。尽管干细胞是一非常有前途的细胞来源,应用于组织工程尚存在一些问题:细胞分离、分化控制及有效性等。组织工程最理想的细胞来源是胚胎干细胞(ES)。ES比MSCs更原始[28]。ES理论上具有分化成体内各种细胞的潜能。当然,同其它干细胞一样,要把ES应用于组织工程,仍然存在许多问题需要解决。临床上已经应用脐带血中分离的造血干细胞进行骨髓移植,和利用自体软骨细胞修复关节软骨[29,30]。然而,尽管应用患者自体细胞非常理想,而临床上要获得这样的细胞却很困难。
2. 体外培养系统
细胞扩增和生物功能或表型的保持是组织工程和器官替代物的两大需求。
体内组织的生长发育过程是在一定的内环境条件下进行的,常规的体外单层培养方法不能提供组织正常生长发育所需的环境条件,通常的后果是细胞发生分化现象,培养的细胞不仅失去了正常的形态,而且失去了其生化与功能性质[31]。
因而需要建立完善的培养系统以对环境因子进行有效的控制。比如,目前正在发展的生物反应器系统,细胞微载体,模拟体内干细胞微环境的3D培养研究等等。
用于组织工程的培养系统的设计原则是通过模拟在体的内环境条件,提供工程组织生长发育所需的必要的生化条件,以及针对不同的组织提供细胞分化所需的特殊条件。实现这一目的除了要求提供足够大的传质速率以保证细胞的生长外,还需要根据所培养的组织类型,在反应器的设计上模拟组织生长发育的微环境状态,促进不同细胞的分化。
在皮肤,表皮干细胞( Epidermal stem cell, ESC)位于基底层,角质形成细胞(Keratinocyte,Kc)位于基底上层,表皮更新模式:表皮干细胞-TA1-TA2…-角质形成细胞。近期的一些文献也提示位于毛囊Bulge区的细胞才是真正的干细胞,它能维持表皮的更新,表皮干细胞可能是其早期的TA细胞。
角质形成细胞是整个机体最外层的细胞,由于容易获得、可体外培养传代和其易接受性,成为基因操作中尤其引人注目的一种靶细胞[242]。另外,由于皮肤覆盖整个机体和靠近循环系统,可作为表达工具,将基因产物经血液输送至全身。
目前,几乎所有的基因转移方法均适用于Kc。早期的研究着重于将Kc作为实验工具,研究Kc本身的特性,而不是将其作为前体细胞用于基因治疗。除逆转录病毒载体和某些脂质体/DNA混合物外,大多数常规用于实验室组织培养细胞系的化学或物理基因转移方法对于正常二倍体Kc并不有效[243]。
目前,表皮干细胞已经被正式鉴定和分离,从单个干细胞可培养成一个很大的细胞群[244]。
表皮干细胞进行分化后,其终末分化细胞就是角质形成细胞,角质形成细胞靠表皮干细胞来维持不断的自我更新。简单的说,表皮干细胞是干细胞,角质形成细胞是子代终末分化细胞。
体外培养的Kc并非永生,一旦达到内在的终点(Hayflick)即停止分裂。可能的原因是在体外并没有有效地模拟成纤维细胞与Kc之间存在的复杂的相互作用[245]。
因此,由于体外培养没有提供与体内相同的环境,干细胞在体外不能显示与在正常皮肤内相同的生物学特性。许多研究者正积极寻找标记物,以特异地靶向干细胞。这对于遗传性疾病的基因治疗非常重要,因为这些疾病需要目的基因的长期表达[246]。因为经过自然的细胞周期,从具有增殖能力的基底层迁移到皮肤表层,转基因的Kc则会丢失。通过转染基因标记物跟踪皮肤内单个细胞的命运,可以研究观察皮肤内干细胞的位置和分化趋势。
毛囊的培养可分为两大类。一类是在三维基质中培养整个毛囊;另一类是单层培养与毛发相关的某一细胞。由于毛囊中存在大量不同类型细胞,毛囊细胞培养非常复杂。毛囊细胞包括外层的根鞘细胞,真皮乳突细胞,真皮根鞘细胞和芽生表皮细胞。许多研究者已经尝试将不同类型毛囊细胞在胶原基质中进行混合培养,或将整个皮肤悬液进行培养[255,256]。
目前认为,角质干细胞(即毛囊干细胞,hair follicle stem cell,HFSC)存在于毛囊的膨胀处。
毛囊干细胞属于成体干细胞,在体内通常处于静止状态,但在一定内环境作用下表现出惊人的增殖能力。研究发现,毛囊干细胞具有多向分化潜能,它可以分化成表皮、毛囊、皮脂腺,参与皮肤创伤愈合的过程。
有研究结果显示,在各种皮肤创伤后,bulge区毛囊干细胞可迁移至表皮。并且,在新生的表皮中,至少有25%的细胞来源于毛囊干细胞。但与预期有出入的是,在新生的表皮中,其他大多数细胞在几周后被清除,表明在表皮创伤过程中,毛囊干细胞参与了创伤的急性修复过程,通过产生短期存在的过渡性放大细胞(TA细胞),对表皮创伤进行快速的回应。
毛囊干细胞在体外培养时呈克隆性生长,具有多向分化潜能,还可诱导分化为神经元细胞,神经胶质细胞,平滑肌细胞和黑色素细胞等细胞,而植入体内则可分化形成神经元、黑色素细胞和角化细胞等。
由于皮肤细胞内毛发特殊细胞只占极小比例,要对这些细胞进行有效的基因治疗,需要采取某种靶向方法。实验显示,脂质体可以选择性地靶向毛囊,由于该技术操作简单,安全,可成为未来应用的基础[235]。脱发的治疗,无论是由于年龄关系的自然脱发还是由于其它治疗如化疗导致的脱发,目前尚无有效的方法。由于毛囊是由多种类型细胞组成的器官而不是某一单个细胞,因而,相对于皮肤的其它基因治疗,毛囊的治疗将面临更大的挑战[212]。
利用微载体生物反应器技术获得足够数量的细胞一直是干细胞与再生医疗领域的研究热点之一。微载体技术其较传统平面细胞培养方式具有许多优势,如在短期内能够提高细胞生长数量,简化了以往复杂繁琐的培养过程,大大节省了空间和人力,并且能为细胞生长提供了一个更适宜的微环境,以保持细胞表型和功能。
微载体是指一些具有特定直径范围且能适合贴壁细胞生长的微珠,其为细胞提供可供贴附的生存空间,并且通过轻度搅动微载体培养基使细胞微载体处于悬浮状态,这种培养方式被称为微载体细胞培养技术。1967年微载体首次由荷兰学者Van Wezel[ 1]研制并运用于生物细胞的培养当中。
微载体技术采用立体培养方式,可在短时间内获得大量细胞,而且细胞传代过程只需要添加新的微载体,免去了过去胰酶消化的过程,大大增加了细胞体外培养的产量。相对于传统的平面静态培养,细胞微载体的悬浮培养其各种环境参数(pH, pO2等)更容易被监测和控制,且具有更大的比表面积供干细胞贴壁生长。
用于微载体制备的材料有很多种,主要有包括壳聚糖、海藻酸盐、胶原、明胶、聚乳酸(PLLA)、聚乳酸-聚羟基乙酸共聚物(PLGA)和纤维素等天然或合成生物材料,这些材料具有生物相容性好、无毒性、免疫原性低、性能可控等优点。
除了材料的构成,微载体的尺寸、形态及表面拓朴结构对细胞的粘附、增殖与分化也有很大的影响。 如带有微孔或大孔的微载体能为细胞提供一个更好的3D微环境,为提供细胞更多的贴附生长空间。同时,可通过对微载体表面进行化学修饰或改性,以增加细胞粘附率并促进细胞生长和分化。在流体动力学作用下,微载体表面的细胞易受剪切力和细胞间碰撞等因素影响,而多孔微载体除了为细胞提供更多的贴附生存空间外,还能最大程度地保护细胞不被这些外界因素影响。
采用生物降解生物材料制备的细胞微载体,还可作为细胞和药物的运载工具将其输送至体内,为病损组织提供了一种全新的治疗途径,因此在肿瘤、慢性疾病、创伤修复等的干细胞治疗和再生医疗领域具有广泛的应用前景。
生长因子(Growth Factor,简称GF)是指具有诱导和刺激细胞增殖、维持细胞表型、控制细胞分化等生物学效应的活性蛋白质或多肽类物质。
生长因子通常存在于生物体内,是一类由细胞表达和具有刺激细胞生长活性的细胞因子,对生物的生长、发育具有广泛调节作用。
细胞生长因子的发现是—个偶然的事情。1948年Bucker把小鼠肉瘤S180细胞植入3天胚龄的鸡胚体壁,进行神经及其靶组织相互作用的研究,几天后却发现了意外的现象--在肿瘤组织内出现了异常丰富的交织成间的交感和感觉神经,并且脊神经节体积明显增大。
后来Rita Montalicini重复这一实验,并从实验结果中提出“肿瘤组织释放一种促神经生长的体液因子--神经生长因子(NGF)--经循环系统作用于有关神经节”的假说。并于1952年将NGF的发现公布于世。从而在细胞生长因子和神经生物学的研究中开辟了一个崭新的领域,并因此获得1986年诺贝尔生理学或医学奖。
60年代,Cohen在比较小鼠颌下腺粗匀浆和从中纯化NGF的生物效应时,又意外地发现经注射粗匀浆的乳鼠比正常乳鼠前几天睁眼,而纯NGF并无此作用。这一意外现象提示:粗匀浆中可能含有使眼裂早开的生物活性物质,结果又从中发现并纯化出了表皮生长因子(EGF),从而进一步推动了细胞生长因子的开拓性研究。与Rita Montalicini一起获1986年诺贝尔生理学或医学奖。
自此,国内外在这个领域的研究如雨后春笋般地蓬勃开展起来,从细胞水平,分子生物学水平及基因工程手段,并深入到了各种作用机制和临床应用、产品转化中,显示出了广泛的生物医学应用前景。
生长因子作为三个关键因素之一,在组织工程与再生医学领域,在促进组织或器官的再生与修复等方面均发挥重要的角色和作用。
生长因子与激素的区别:
1)来源不同:
在分泌特点上,激素是属于内分泌,即从一个器官中产生、再通过血管才能作用于其它器官或细胞上。而细胞生长因子属于自分泌或旁分泌,即其作用的细胞有些是自身细胞、有些是邻近细胞。
如生长激素(HGH)是腺垂体细胞分泌的蛋白质,是一种肽类激素。正常情况下,生长激素HGH呈脉冲式分泌,生长激素的分泌受下丘脑产生的生长激素释放素的调节,还受性别、年龄和昼夜节律的影响,睡眠状态下分泌明显增加。
与激素明显不同的是,生长因子还具有内在分泌的特点。即生长因子不仅有自分泌与旁分泌的持性,还有未分泌出来即作用于细胞核本身,即不经过细胞膜上受体而发挥作用。
2)功能不同:
生长激素的主要生理功能是促进神经组织以外的所有其他组织生长;促进机体合成代谢和蛋白质合成;促进脂肪分解;对胰岛素有拮抗作用;抑制葡萄糖利用而使血糖升高等作用。
而生长因子是具有刺激细胞生长活性的细胞因子。一类通过与特异的、高亲和的细胞膜受体结合,调节细胞生长与其他细胞功能等多效应的多肽类物质。由于细胞生长因子都是正常细胞分泌的生物活性物质、既无药物类的毒性,又无激素的副作用,也无免疫反应.故深受人们的欢迎和重视。
【更多内容】
在组织工程与再生医学领域,生长因子作为细胞、生物支架之外的三个关键因素之一,对促进组织或器官的再生与修复均具有重要的作用。
目前,组织工程中常用的生长因子有表皮细胞生长因子(EGF)、血小板衍生生长因子(PDGF)、碱性成纤维生长因子(bFGF)、神经生长因子(NGF)、内皮细胞生长因子(EGF)、转化生长因子-β(TGF-β)、骨形态发生蛋白(BMPs)和骨衍生生长因子(BDGF)等等。
根据聚合物的药物释放特性可以实现生长因子在支架材料内的控制释放。采用一定的加工方式(如微胶囊包裹、气体发泡、电纺丝等)将生长因子包埋于生物可降解高分子组织工程支架内,利用聚合物疏水的特点防止生长因子与水接触,在体外或体内有水环境下可较长时间保持生长因子活性。利用高分子的降解性和对药物的选择通透性,使生长因子以一定的速率从支架内缓慢释放,发挥其生物学作用。
通过这种方式,一方面解决了生长因子容易失活的问题,为组织工程中生长因子的应用提供了一条新的途径;另一方面,将生长因子复合入组织工程支架内,使支架材料真正具有功能性。
生长因子缓释的聚合物支架除了为细胞生长和组织再生提供所需要的空间和力学支持,还可促进细胞的增殖、分化和组织再生。
然而,如何保持生长因子在聚合物支架内的活性,目前还存在许多困难。无论是支架加工过程还是生长因子从支架内的释放过程,一些相关因素如有机溶剂、高温、酸碱性和降解产物等,均会导致生长因子蛋白质的失活和降解[59]。
因此,在最近的一些研究中,人们试图应用生长因子基因与支架材料复合,通过基因的局部缓慢释放,转染周围的细胞,让细胞表达组织修复所需要的生长因子[60-62]。这一途径的实现,可望真正解决组织工程和再生医学中生长因子的应用问题[63]。
1902年,伦敦大学医学院的两位生理学家贝利斯(Bayliss)和斯塔林(Starling)发现动物胃肠中一种能引起胰腺分泌活动的物质,即促胰液素,因是人类第一次发现活性多肽物质而被授予诺贝尔生理学奖。德国科学家费雪Hermann Emil Fischer开拓了对蛋白质的研究,确定了氨基酸通过肽键形成多肽,并成功合成了多肽。因合成了全世界第一个多肽类物质,以及对嘌呤和糖类的合成研究,1902年荣获诺贝尔化学奖。
1923年,约翰·麦克劳德(John Macleod)与弗雷德里克(Sir Frederick Grant Banting)发现了胰岛素,获得诺贝尔生理学或医学奖。
1955年,美国科学家文森特·迪维尼奥(Vincent DuVigneaud)因合成多肽激素—催产素而获得诺贝尔化学奖。
1958年,美籍犹太人生物化学家赫伯特·博意尔(Herber Boyer)利用细胞重组技术经过38年研究,发现活性多肽(HGH)控制着蛋白质的合成数量、质量和速度,控制着人体的疾病与衰老,获得当年的诺贝尔生物学奖。
1977年,美国科学家罗歇·吉耶曼(Roger Guillemin),安德鲁·沙利(AndrewV.Schally)因发现大脑分泌的多肽类激素;罗莎琳·苏斯曼·雅洛(Rosalyn Sussman Yalow)因开发多肽类激素的放射免疫分析获诺贝尔生理学或医学奖。
1984年,美国生物化学家梅里菲尔德(Bruce Merifidd)因发明多肽固相合成法以及发展新药物和遗传工程的重大贡献,使多肽研究具备商业生产价值从而获得当年诺贝尔化学奖。
1986年,美国科学家斯坦利·科恩(Stanley Prusiner)和意大利神经生物学家丽塔·列维·蒙塔尔奇尼(Rita Levi-Montalcini)(1909-2012,享年103岁,长寿的诺贝尔奖获得者)因发现生物活性多肽”神经生长因子”和”表皮生长因子”(1962年发现)共同获得当年度诺贝尔医学奖。EGF具有修复受损病变细胞、调节细胞生命周期、激活衰老细胞、调控细胞间离子代谢通道对人体各大系统的综合调理促进作用。
1993年,美国科学家艾伦西伯尔(Alan siebel)做出了肽在医学领域中对人体细胞和基因的修复、调理、激活作用的科研成果,使其获得了当年的诺贝尔奖。经权威机构评估,其价值超过了人类历史上发现的任何一种物质。
1999年,美国纽约洛克菲勒大学生物学家古特·布洛伯尔(Gtinter Blobel)因发现信号肽及细胞如何以蛋白质讯号序列(信号肽)控制蛋白质运输被授予诺贝尔生理学或医学奖(诺贝尔化学奖?)。
2000年,美国神经科学家保罗·格林加德(Paul Greengard)和埃里克·坎德尔(Eric Richard Kandel)因发现了多巴胺和一些其他脑内的传送物在神经系统的运作原理,共同获得当年诺贝尔生理学或医学奖。
2000年, 脑神经信号肽,瑞典科学家阿尔维德·卡尔森(Arvid Carlsson)因研究脑神经传导讯息蛋白质分子机制(信号肽)荣获诺贝尔化学奖。
2001年, 美国科学家利兰·哈特韦尔(Leland H Hartwell),因研究蛋白质基因与CDK素(生命能量肽)对细胞周期的控制,荣获诺贝尔化学奖。
2004年,以色列科学家阿龙·切哈诺沃(Aaron Ciechanover)、阿夫拉姆·赫什科(Avram Hershko)和美国科学家欧文·罗斯(Irwin Rose)因发现调节蛋白质降解的泛素(多肽),共同获得当年诺贝尔化学奖。
2006年,安德鲁·法尔美国科学家Andrew Z. Fire,克雷格·梅洛美国科学家Craig C. Mello,发现RNA肽链. 发现一种控制基因信息流动的机制(RNA肽链),而获得诺贝尔生理医学奖。
2006年,罗杰·科恩伯格Roger D. Kornberg,描绘出DNA转录机制(肽链),凭着描绘出 真核生物细胞 脱氧糖核酸(DNA) 的转录机制(肽链)而获得诺贝尔化学奖。
2009年,美国科学家杰克W. 卓斯塔克Jack W.Szostak,美国科学家卡罗尔-格雷德Carol W.Greider,美国科学家伊丽莎白H. 布莱克本Elizabeth H.Blackburn,在端粒和端粒酶如何保护染色体方面的发现(肽链、肽段) 而荣获诺贝尔生理医学奖。
朱棣文教授,美国华裔物理学家,诺贝尔奖获得者朱棣文曾断言:21世纪是多肽的世纪。生于美国圣路易斯祖籍江苏太仓中国科学院外籍院士。获得1997年诺贝尔物理学奖2009年任职美国能源部部长。
碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF))属于成纤维细胞生长因子(fibroblast growth factor, FGF)大家族中的一员,FGF主要参与人体的血管生成、伤口愈合、胚胎发育和各种各样的内分泌调节作用。
FGFs是一种肝素结合生长因子,它们与细胞表面的硫酸肝素聚醣相互作用来展现重要的细胞信号转导作用。FGFs在各种各样的细胞和组织中展现了促进细胞增殖、细胞迁移和促进细胞分化的作用。
人体中,FGFs家族包含了22个主要成员,FGFs家族成员中的分子量从17-34kDa不等,他们的氨基酸同源性从13-71%[6, 7]。
FGFs是一群多功能蛋白,能够在体内发挥各种各样的作用。它们的最基本作用是细胞有丝分裂素,同时也能够调控细胞的形态、以及调控体内的内分泌。因此,FGFs被人们称为“多潜能细胞因子”[8]。
在细胞表面主要存在4个FGF受体,FGFs的22个成员都能够与这4种受体能够结合,从而激活细胞内响应的细胞信号转到通路。在脊椎动物和非脊椎动物的发育过程中起着至关重要的作用,任何的FGFs细胞因子的不充分表达都能够引起各种发育缺陷[9-12]。
FGF1和FGF2一个重要的功能就是促进内皮细胞的增殖,因此能够有效促进血管的生成,促进从组织内已经存在的血管处生长新的血管。FGF1和FGF2促血管生成能力强于血管内皮细胞生长因子(vascular epithelial growth factor, VEGF)和血小板诱导生长因子platelet-derived growth factor(PDGF)[13]。
在临床中,FGF1和FGF2也广泛的应用在促进心肌中血管生长的研究工作[Stegmann, 1999, New approaches to coronary heart disease – Induction of neovascularisation by growth factors][14]。FGF1和FGF2除了能促进血管生成,通过促进血管生成和成纤维细胞的增殖,还能够有效的促进伤口部位肉芽的生成,而这些新生的肉芽能够迅速填充创伤带来的缺损组织,从而实现对创伤部位的修复过程。
FGF7和FGF10也被称作角质细胞生长因子,通过刺激和促进上皮细胞的增殖、迁移和分化能够加速皮肤的修复和粘膜组织的再生。
在胚胎的中枢神经的发育过程中,FGFs在神经干细胞的增殖、神经新生、轴突的生长和细胞的分化过程也起着关键的作用。FGF2也可以被用来诱导小鼠大脑皮层褶皱的增加[15]。其它的FGFs家族成员FGF8调控大脑皮层的功能区位置和面积大小[16, 17]。FGFs在维持成人大脑机能方面也是十分重要的。因此,FGFs无论在胚胎发育期和成年期的神经元生长和存活方面都起着关键作用[18]。成人的海马区神经发育也依赖大量的FGF2。
|
转化生长因子β(transforming growth factor, TGF-β)和BMPs均属于TGF-β超家族的一员,它能够调节多种细胞的生长和分化。 体内多种细胞都可以分泌没有活性状态的TGF-β。在体外,没有活性状态的TGF-β又称为latency associated peptide(LAP)。在体内,骨折附近和正在愈合的伤口位置一般呈现酸性环境,在酸性环境中LAP能够被活化。高水平的TGF-β一般被发现在细胞正在处于高度分化活动的组织,如存在于成骨细胞、肾脏、骨髓和胎肝的造血细胞。 FERNANDEZPOL, JA等人在1985年,从L929细胞中成功的纯化了TGF-β细胞因子,并在大肠杆菌内得到表达[5]。在哺乳动物至少发现有TGF-β1、TGF-β2、TGF-β3、TGF-β1β2四个亚型。在鸟类和两栖类动物还分别存在着TGF-β4和TGF-β5,对后两者的生物学作用所知甚少。 TGF-β的生物学功能研究主要在炎症、组织修复和胚胎发育等方面,发现TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用。 TGF-β1、β2和β3功能相似,一般来说,TGF-β对间充质起源的细胞起刺激作用,而对上皮或神经外胚层来源的细胞起抑制作用。 TGF-β的对于细胞的调控和刺激主要有如下一些作用: (1)抑制免疫活性细胞的增殖:①抑制IL-3、GM-CSF、M-CSF所诱导小鼠造血前体细胞和LTBMC的集落形成,并降低巨核细胞对IL-3T和CSF的反应性。②抑制ConA诱导或ConA与IL-2、IL-6联合诱导的胸腺细胞增殖。③抑制丝裂原、同种异体抗原刺激的T细胞增殖或IL-2依赖的T细胞生长。④抑制SAC刺激后IL-2依赖的B细胞增殖。 (2)对细胞表型的调节:①抑制IL-2诱导的T细胞IL-2R、TfR和TLiSA1活化抗原的表达,对CD3表达未见有影响。②抑制IFN-γ诱导黑素瘤细胞MHCⅡ类抗原表达。 (3)抑制淋巴细胞的分化:①抑制IL-2和BCDF依赖的B细胞分泌IgM,促进B细胞分泌Ig类型转换为IgA和IgE。②抑制混合淋巴细胞培养(MLC)中CTL、NK和LAK功能,这种抑制作用可被TNF-α(小鼠MIC)或IL-2(人MLC)所逆转。③抑制PBMC中NK活性以及NK细胞对TNF-α的的以应性。④抑制ConA和IL-2、IL-6协同诱导小鼠胸腺MHC非限制杀伤性细胞的活性。 (4)抑制细胞因子产生:如抑制PBMC中IFN-γ和TNF-α的产生。 (5)其它调节作用:①促进成纤维细胞、成骨细胞和雪旺氏细胞的生长。TGF-β1、TGF-β2促进人成纤维细胞IL-6的产生,其机理可能是通过对IL-6基因转录的调节。②抑制上皮细胞、破骨细胞、内皮细胞生长和脂肪、心肌、骨骼肌的形成。TGF-β可拮抗EGF的某些生物学功能。③促进细胞外基质(ECM)如胶原蛋白、纤粘连蛋白的表达和抑制ECM的降解,对细胞的形态发生、增殖和分化过程起着重要作用,有利于胚胎发育和细胞修复。动物体内实验表明,局部注射TGF-β可以促进伤口愈合和典型肉芽组织形成。④单核细胞和成纤维细胞的趋化剂,但不引起胶颗粒和氧化物的产生。⑤抑制淋巴细胞与内皮细胞的粘附。⑥促进嗜碱性粒细胞释放组织胺。 (6)TGF-β1与原癌基因表达:TGF-β1能诱导c-sis的表达,但抑制c-myc的表达,这种诱导或抑制作用与作用细胞种类及TGF-β的不同功能有关。如TGF-β诱导成纤维细胞中c-sis基因表达,与促进其在软琼脂中生长有关;而对上皮角朊细胞生长的抑制则与抑制c-myc基因表达有关。TGF-β1、TGF-β2和TGF-β3在大多数生物学作用方面非常相似,但在有些作用方面可有很大差异,如TGF-β2对血管内皮细胞和造血祖细胞的生长抑制作用仅为TGF-β1和TGF-β3的1%。
TGF-β在治疗伤口愈合,促进软骨和骨修复以及通过免疫抑制治疗自身免疫性疾病和移植排斥等方面有潜在的应用前景。
|
1963年,美国的教授Marshall R.Urist发现了骨形态发生蛋白(bone morohogenetic protein,BMPs)。BMPs对于促进骨和软骨生成以及诱导间充质干细胞向成骨细胞分化具有十分显著的效果。
BMPs是一个大家族,这个大家族包含很多的不同克隆,其中主要成员的功能和作用见表1:
表1:BMPs家族中不同成员在体内的主要功能和作用
|
BMPs不同克隆 |
主要功能 |
基因位置 |
| BMP1 不属于TGF-β 家族蛋白,它是一种金属蛋白作用于I,II型胶原前体,也参与软骨的形成。 | Chromosome: 8; Location: 8p21 | |
| 它是一种由二硫键形成的同源二聚体双链蛋白,作用于骨和软骨的形成。在成骨细胞分化中起着至关重要的作用 | Chromosome: 20; Location: 20p12 | |
| 诱导骨的形成 | Chromosome: 14; Location: 14p22 | |
| 调节中胚层中牙齿、肢体骨的形成。它在骨折、表皮修复中也起着重要的角色 | Chromosome: 14; Location: 14q22-q23 | |
| 在软骨形成中起着重要作用 | Chromosome: 6; Location: 6p12.1 | |
| 维持成人关节功能,控制体内铁的平衡 | Chromosome: 6; Location: 6p12.1 | |
| 成骨细胞分化中起着重要角色. 能够诱导SMAD1合成. 在肾脏的发展和修复中起作用 | Chromosome: 20; Location: 20q13 | |
| 参与到骨和软骨的形成 | Chromosome: 1; Location: 1p35–p32 | |
| 在海马中表达 | Chromosome: 1; Location: 1p35–p32 | |
| 在胚胎心脏的小梁形成中其重要作用 | Chromosome: 2; Location: 2p14 | |
| 可能在卵母细胞的发展中起着重要作用 | Chromosome: X; Location: Xp11.2 |
在BMPs家族中,BMP-2对于新骨的生成和细胞向成骨细胞诱导分化的能力也是最为显著的。研究表明当使用极其微量的BMP-2作用于骨髓间充质细胞(MSCs)后,MSCs的碱性磷酸酶(ALP)含量呈现显著上升趋势,并且ALP的含量和BMP-2的浓度呈现了浓度线性依赖关系。
ALP是一种普遍存在于细胞内的酶,ALP含量是一种关键的成骨细胞功能及分化的指标,在骨相关疾病的研究中具有十分重要的研究价值和科学意义,定量检测细胞内ALP的活性同时也具有十分重要的临床意义。BMP-2对于细胞中ALP水平的促进作用说明了BMP-2的成骨诱导能力和诱导活性[2]。
BMP-2和BMP-7能够诱导MSCs向软骨细胞分化,能够软骨细胞的增殖和软骨细胞外基质的合成,因此在软骨损伤相关疾病的治疗中能够起到关键的作用[3, 4]。
自从1986年 Rita Levi-Montalcini和Stanley Cohen两位科学家因生长因子研究而获得 诺贝尔理学或医学奖以來,有关生长因子将来的转化应用研究就一宵成为人们关注的 焦点。
生长因子与细胞分化、发育、免疫、肿瘤形成、某些先天性疾病发病以及组织修复和再生等均存在着密切的关系。因此,这些领域都有可能成为生长因子转化应用的主战场,而谁先突破从实验室研究、生产到临床应用的瓶颈,将是占领这一重要应用高地的领先者。
20世纪90年代以来,我国抓住了这一先机,通过产学研的紧密结合,在国际上最早将重组牛碱性成纤维细胞生长因子(bFGF)从实验室的 基础研究迅速转化为可供临床治疗应用的国家一类新药。这一过程是一个典型的从临床治疗需求为引导,通过实验室和工程技术的合作研究,通过产业化的孵化过程,最终生 产国家一类新药并应用于临床应用的转化医学过程。
选择一个具有挑战性和跨越性的突破点:1988年以来,我一直在思考这个问题,实际上促进创面愈合的方法过去已经有了很多,比如说祖国的传统医学中许多制剂就有这方面的作用。而真正促进损伤组织的快速修复与愈合,最重要的环节还是调动机体组织自身内源性的修复因素,而其中机体组织中存在的各种生长因子(也称细胞因子) 就是最重要的修复调节因素之一,这也符合辩证法中有关外因通过内因起作用的原则。
这些重要的生长因子包括表皮细胞生长因子(EGF)、成纤维细胞生长因子(bFGF)、血小板生长 因子(PDGF)等。由于传统的领域主要是从病理学來研究创面愈合,主要停留在细胞水平, 而真正从分子生物学,从蛋白和基因水平来研究则非常少,所参考的资料也有限。
当时的文献报道已经显示出生长因子对创面修复和组织再生存在的影响和作用,因此,就把整个学科的发展方向定为创(战、烧)伤医学,研究重点聚焦在损伤组织的修复特別是集中在有关生长因子调控组织修复与再生医学领域。
1990年,我用半年时间作阅读了大量国内外参考文献,撰写了国际上第一 部论述《生长因子与创伤修复》的学术专著。这部专著从科普的角度将这几年来有关生长因子生物学及其在组织修复与再生领域的初步应用知识介绍给国内读者,应该说在一定程度上起到了启蒙和助推的作用。成为从事这个领域和相关领域的科技工作者和临床医生必读的参考教材。我们通过部分研究证明生长因子确实在创伤治疗中起到了较大的作用。我们通过火器伤模型以及动物的切割伤模型,从创面愈合的速度、质量、病理学指标以及化学指标改变等,向同道们展示了它促进组织修复与再生的神奇效果。作为从分子水平研究创伤修复与再生的重要开拓之一受到国内外学术界的关注。也可以 说是通过敏锐的观察和决断的选择,确定一个创新领域和发展的突破点。
与企业结合使生长因子从实验室走向产业化:如何使生长因子在国内能够生产和实现产业化并最终走向临床是我们思考的和需要解决的第二个难题。客观来说,我们自己不生产生长因子,但是我们的相关研究工作却对重组牛碱性成纤维细胞生长等多种生长因子新药从实验室走向临床,走向市场起到了关键性的作用。
当时国内率先从事生长因子基因工程药物研发的是以暨南大学副校长林剑教授为代表的老一代生物学家的团队。当时广东珠海成立了一家名为东大生物制药的公司,专门从事以重组牛碱性成纤维细胞生长为代表的基因工程国家一类新药的生产。20 世纪90年代初他们通过大肠杆菌表达技术已经能够生产出一定量的重组牛碱性成纤维细胞生长因子产品,但是他们面临的巨大难题是:
(1)这个生长因子到底对创面修复和组织再生有没有作用?
(2)到底用多大剂量和什么时间应用这个因子能够对创面修复产生作用?
(3)由于严重烧伤创面一般是瘢痕修复,而瘢痕修复的细胞学基础是成纤维细胞功能亢进,因此要考虑成纤维细胞生长因子促进创面修复是否会加重烧伤以后创面的瘢痕形成。
(4)由于在部分肿瘤组织中发现生长因子的高表达,那么将成纤维细胞生长因子应用于创面会不会导致肿瘤的发生?
这些问题,基因工程制药公司的专家难以回答,变成了他们药物研发当中遇到的巨大障碍,也是必须尽快解决的科学问题。这个时候医学科学研究与制药生产企业的密切结合就突显出其重要的作用。
当时该公司的相关人员告诉我,他们在申报新药答辩的时候,一方面手拿《生长因子与创伤修复》这本专著,用其中的理论来告诉新药评审专家和相关管理人员,生长因子对创面愈合是有作用的。但另一方面,当他们被问及有关生长因子的剂量-效应关系、临床医生对安全性的担心等问题时,他们就难以回答了。
还有一个问题,小玻璃瓶中存储的生长因子是以毫克或毫微克计,非常微量,医生和病人根本看不见摸不着,所以应用吋常被误认为是空瓶。
为此,我们迅速与该企业建立了一种紧密的学术关系,这种关系一方面是我们需要企业来提供生长因子来进一步深化我们有关从分子水平调控创伤修复与组织再生的相关理论,另一方面企业需要我们的理论来支撑新药的研发,这是一个利益的共同体。
1994一1998年,我们通过大量的动物实验、细胞学实 验、分子生物学实验以及部分临床病例的观察,比较全面和系统地阐明了几种重要生长因子调控各种急性、慢性难愈合创面的愈合机制,客观地提供了国产生长因子促进 创面修复的剂量一效应关系以及对不同创面的给药时间和剂量等,同时也考察了这些因子应用于创面以后可能给患者带来的不良反应以及安全性等指标。特別是我们创建的一种用于评价生长因子调控创面愈合的动物模型以及提出为生长因子添加赋型剂(添加了赋型剂如甘露醇等以后,装在小瓶中的生长因子就由“不可见” 变为“可见” 了)的建议,为这些关键学术和技术问题的解决提供了重要手段。为他们新药申报资料和获得报批提供了重要的数据,使得该企业仅用了8年时间就获得国际上第一个用于创伤治疗的基因工程国家一类新药重组牛碱性成纤维细胞生长因子,实现了 产业化并真正造福于患者。
有关生长因子调控创伤修复和组织再生关键理论和评价技术方法的突破,使得整个 生长因子研发领域呈现出蓬勃发展势态。我们先后与桂林华诺威、深圳华生园等6家企 业合作先后参加了重组人表皮细胞生长因子等3个国家一类新药的评价与转化应用,为其研发提供了关键的理论支撑,获得了企业的一致好评。
摘编自“生长因子:从实验室研究到临床治疗的转化应用&付小兵。《转化医学理念、策略与实践》戴克戎主编.,2014.10”